
科目: 来源: 题型:
【题目】牛通过吃草从草中获得化合物和元素,那么,牛和草体内的各种化学元素( )
A. 种类差异很大,含量大体相同
B. 种类和含量差异都很大
C. 种类和含量都是大体相同的
D. 种类大体相同,含量差异很大
查看答案和解析>>
科目: 来源: 题型:
【题目】某学生在如图所示的装置中用苯和液溴制取溴苯,请根据下列实验步骤回答有关问题. 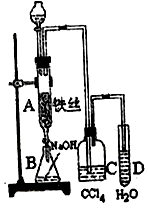
(1)写出A中发生的有机反应的化学方程式;
(2)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是 , 然后用仪器分离出溴苯(仍含有少量苯);
(3)反应完毕后,向试管D中滴加AgNO3溶液有(填现象)生成,此现象说明这种获得溴苯的反应属于反应(填有机反应类型)
查看答案和解析>>
科目: 来源: 题型:
【题目】铁、铝等金属单质及其化合物在生产和生活中有着广泛的应用。
(1)金属冶炼与处理常涉及氧化还原反应,由下列物质冶炼相应金属单质时采用电解法的是_________。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)某研究性学习小组设计了如图所示装置探究钢铁的腐蚀与防护。

为防止金属Fe被腐蚀,可以采用上述_______(填装置序号)装置原理进行防护;装置③中总反应的离子方程式为______________________________________________。
(3)利用甲醇(CH3OH)、氧气组成燃料电池,电解质溶液为碱性,电池工作时负极反应式为_____________。
(4)氨气也可作为燃料电池的燃料源制成高效率无污染的燃料电池系统,总反应式为:![]() (未配平),写出此碱性燃料电池的负极反应式:_______。
(未配平),写出此碱性燃料电池的负极反应式:_______。
(5)高铁酸钾(K2FeO4)是一种强氧化剂,可作为水处理剂和高容量电池材料。与MnO2-Zn电池类似,K2FeO4-Zn也可以组成碱性电池,K2FeO4在电池中作为正极材料,其电极反应式为_________________________。
(6)科学家制造出一种使用固体电解质的燃料电池,其效率高无污染,多用于航天航空。如图所示装置中,以稀土金属材料作惰性电极,在两极上分别通入CH4和空气,其中固体电解质是掺杂了Y2O3的ZrO3固体,它在高温下能传导阳极生成的O2-(O2+4e-=2O2-),d电极上的电极反应式为_____________________。
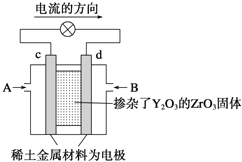
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)利用反应![]() 可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
可制备CuSO4溶液,且反应简便无污染,若将该反应设计为原电池,其正极电极反应式为_____________________。
(2)工业上由黄铜矿(主要成分CuFeS2)冶炼铜的过程中会产生二氧化硫气体和固体熔渣混合物,用稀H2SO4浸泡熔渣,取少量所得溶液,滴加KSCN溶液后呈红色,说明溶液中存在Fe3+,检验溶液中是否存在Fe2+的最好的方法是_________________________(用化学反应方程式或离子方程式说明)。
(3)以CuSO4溶液为电解质溶液进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,下列说法正确的是_______________。
a.电能全部转化为化学能 b.粗铜接电源正极,发生氧化反应
c.溶液中Cu2+向阳极移动 d.利用阳极泥可回收Ag、Pt、Au等金属
(4)用惰性电极电解CuSO4溶液,若只有阳极产生气体,则所得溶液的pH_______(填变大、变小、不变,不考虑溶液体积变化),要使电解质溶液恢复到电解前的状态,可加入____________;若阴阳两极均有气体生成,要使电解质恢复到电解前的状态,可加入__________,当加入该物质1mol即恢复到电解前状态,则电解时电路中转移电子的物质的量为__________摩尔。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.SF6是一种优良的绝缘气体,分子结构中,只存在S—F键,已知1 mol S(s)转化为气态硫原子吸收能量280 kJ,F—F键能为160 kJ·mol-1,S—F键能为330 kJ·mol-1,试写出S(s)和F2(g)反应生成SF6(g)的热化学方程式_______________________________。
Ⅱ.V、W、X、Y、Z是由四种短周期元素中的2种或3种组成的5种化合物,其中W、X、Z均由2种元素组成,X是导致温室效应的主要气体,Z是天然气的主要成分,Y、W都既能与酸反应,又能与强碱溶液反应。上述5种化合物涉及的四种元素的原子序数之和等于28;V由一种金属元素A和两种非金属元素B与C组成,其化学式构成为A(BC3)3 。它们之间的反应关系如下图:

(1)写出物质W的一种用途:__________________________________________________。
(2)写出V与足量NaOH溶液反应的化学方程式:________________________________。
(3)将少量的X通入某种物质的水溶液中可以生成Y,该反应的离子方程式为________________________________________________________________________。
(4)写出气体X的结构式__________。
(5)以Z为燃料,活性炭为电极,熔融碳酸盐(如熔融K2CO3)环境下制成燃料电池的负极反应式为_________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以硼镁泥为原料制取的硫酸镁可用于印染、造纸、医药等工业。硼镁泥是一种工业废料,主要成分是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质。从硼镁泥中提取MgSO4·7H2O的流程如下:

(1)实验中需用3 mol·L-1的硫酸500 mL,若用98%的浓硫酸(ρ=1.84 g·mL-1)来配制,量取浓硫酸时,需使用的量筒的规格为 ________(填字母)。
A.10 mL B.20 mL C.50 mL D.100 mL
(2)加入的NaClO可与Mn2+反应,方程式为Mn2++ClO-+H2O===MnO2↓+2H++Cl-,
欲使2moL Mn2+被氧化则至少需要氧化剂NaClO质量为______g;还有一种离子也会被NaClO氧化,该反应的离子方程式为______________________________________。
(3)滤渣的主要成分除含有Fe(OH)3、Al(OH)3外,还含有________、_________。
(4)在“除钙”步骤前,若要检验混合液中是否还存在Fe2+,简述检验方法:_____________________________________。
(5)已知MgSO4、CaSO4的溶解度如下表(溶解度单位为g/100 g水):
温度/℃ | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤:蒸发浓缩、_________。“操作Ⅰ”是将滤液继续蒸发浓缩,冷却结晶,__________,便得到了MgSO4·7H2O。
(6)若实验中提供的硼镁泥共100 g,得到的MgSO4·7H2O为86.1 g,则MgSO4·7H2O的产率为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】部分氧化的Fe-Cu合金样品(氧化产物为Fe2O3、CuO)共5.76 g,经如下处理:
下列说法不正确的是
A. 滤液A中的阳离子为Fe2+、H+
B. 样品中铁元素的质量为2.24 g
C. 样品中CuO的质量为4.0 g
D. V=448 mL
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是利用一种微生物将废水中的有机物(如淀粉)和废气NO的化学能直接转化为电能,下列说法中一定正确的是
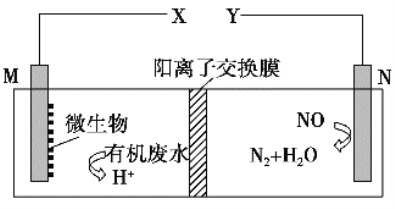
A. 质子透过阳离子交换膜由右向左移动
B. 与X相连接是用电器标有“+”的接线柱
C. M电极反应式:(C6H10O5)n+7nH2O-24ne-===6nCO2↑+24nH+
D. 当M电极微生物将废水中16.2 g淀粉转化掉时,N电极产生134.4 L N2(标况下)
查看答案和解析>>
科目: 来源: 题型:
【题目】某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应. 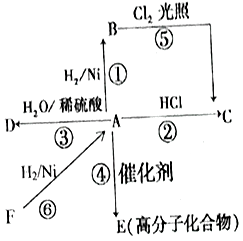
根据上图回答下列问题:
(1)写出A和D的结构简式:A , D .
(2)写出②⑤两步反应的化学方程式,其中②属于反应. ②;
⑤ .
(3)写出实验室中制取F的化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】电解装置如图所示,电解槽内装有KI及淀粉溶液,中间用阴离子交换膜隔开。在一定的电压下通电,发现左侧溶液变蓝色,一段时间后,蓝色逐渐变浅。已知:3I2+6OH-═IO3-+5I-+3H2O下列说法不正确的是( )
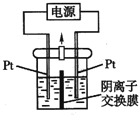
A. 右侧发生的电极方程式:2H2O+2e-═H2↑+2OH-
B. 电解结束时,右侧溶液中含有IO3-
C. 电解槽内发生反应的总化学方程式:![]()
D. 如果用阳离子交换膜代替阴离子交换膜,电解槽内发生的总反应不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com