
科目: 来源: 题型:
【题目】铝及其合金在生活、生产中有广泛应用。
(1)最新研究表明:氢氧化铝溶于氢氧化钠溶液中生成Na[Al(OH)4]。则氢氧化铝在水中发生酸式电离的电离方程式为________________________________。
(2)目前,国内对真空碳热还原-氯化法冶炼铝的研究较多,利用该方法冶炼金属铝,既节能又环保。
已知:①Al2O3(s)+AlCl3(g)+3C(s)=====3AlCl(g)+3CO(g) △H1
②3AlCl(g)====2Al(l)+AlCl3(g) △H2
③Al(l)====Al(s) △H3
则Al2O3(s)+3C(s)====2Al(s)+3CO(g) △H4=___________(用含△H1、△H2、△H3的代数式表示)。
(3)已知:Al4C3是真空碳热还原-氯化法冶炼铝的中间产物,它与水反应生成气体Y,Y是含氢量最大的烃。向2L恒容密闭容器中充入2mol Y和2mol水蒸气,一定条件下发生反应a Y(g)+bH2O(g) ![]() c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。
c CO(g)+dH2(g) △H。测得Y的平衡转化率α(Y)与温度、压强的关系如图所示。

①上述反应的△H_______0(填“>”“<”或“=”)。
②图象中,x_________0.1(填“>”“<”或“=”)。
③在T0K、0.1MPa时,上述反应的平衡常数K=____________。
④提高上述反应的反应速率的措施有_______________________________ (任填二项)。
⑤从上述反应体系中分离出H2(还含有少量CO)作为合成氨的原料气,为避免CO使催化剂中毒,原料气在通入合成塔之前需与适量NH3混合,并用[Cu(NH3)2]Ac溶液吸收CO,反应原理为[Cu(NH3)2]Ac(aq)+CO(g)+NH3(g) ![]() [Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
[Cu(NH3)3]Ac·CO(aq) △H<0。若从温度、压强两方面考虑,用[Cu(NH3)2]Ac溶液吸收CO的适宜条件是________________________。
(4)我国首创的海水电池以铝板为负极,以接触空气的铁铂合金网为正极,以弱碱性的海水为电解质溶液,电池总反应为4Al+3O2+6H2O===4Al(OH)3。试写出海水电池的正极反应式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,已知弱酸的电离常数:K(CH3COOH)=1.8×10﹣5;K1(H2CO3)=4.4×10﹣7;K2(H2CO3)=4.7×10﹣11;K(HClO)=4.0×10﹣8 . 则下列说法正确的是( )
A.25℃时,0.1mol/L的醋酸溶液比0.01mol/L的醋酸溶液的K值小
B.25℃时,甲基橙滴入0.1mol/L的醋酸溶液中,溶液呈黄色
C.新制氯水与碳酸氢钠不反应
D.等物质的量浓度的碳酸钠溶液、醋酸钠溶液、次氯酸钠溶液的pH:pH[Na2CO3(aq)]>pH[NaClO(aq)]>pH[CH3COONa(aq)]
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu2SO3·CuSO3·2H2O是一种深红色固体(以下用M表示)。某学习小组拟测定胆矾样品的纯度,并以其为原料制备M。
已知:①M不溶于水和乙醇,100℃时发生分解反应;
②M可由胆矾和SO2为原料制备,反应原理为3Cu2++6H2O+3SO2![]() Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
Cu2SO3·CuSO3·2H2O↓+8H++SO42-。
I.测定胆矾样品的纯度。
(1)取w g胆矾样品溶于蒸馏水配制成250mL溶液,从中取25.00mL于锥形瓶中,加入指示剂,用c mol·L-1EDTA(简写成Na4Y)标准溶液滴定至终点(滴定原理:Cu2++Y4-====CuY2-),测得消耗了V mL EDTA标准溶液。则该胆矾样品的纯度为____________%(用含c、V、w的代数式表示)。如果滴定管装液前没有用EDTA标准溶液润洗,测得的结果会_________ (填“偏高”“偏低”或“无影响”)。
Ⅱ.制备M。实验装置如下图所示:
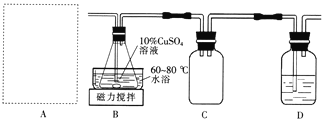
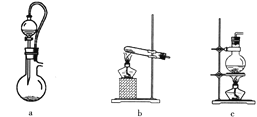
(2)实验室用70%硫酸与亚硫酸钠粉末在常温下制备SO2。上图A处的气体发生装置可从下图装置中选择,最合适的是________(填字母)。
(3)装置D中的试剂是____________。装置B中水浴加热的优点是____________________。
(4)实验完毕冷却至室温后,从锥形瓶中分离产品的操作包括:__________、水洗、乙醇洗、常温干燥,得产品Cu2SO3·CuSO3·2H2O。检验产品已水洗完全的操作是_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期主族元素a、b、c、d、e的原子序数依次增大,b是地壳中含量最高的元素,e的单质的熔点在同周期元素中最高,a、b的原子序数之和等于e的原子序数,d原子的核外电子层数等于最外层电子数:分别向cdb2溶液、c2eb3溶液中通入气体ab2,产生沉淀的质量与通入气体的体积的定性关系都可用右图表示。下列说法不正确的是
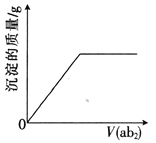
A. 原子半径:c>d>e>a>b
B. 工业上通常采用ab高温还原d2b3的方法冶炼d的单质
C. 同温下,0.1mol·L-1c2eb3溶液的pH大于0.1mol·L-1c2ab3溶液
D. 简单氢化物的热稳定性:b>a>e
查看答案和解析>>
科目: 来源: 题型:
【题目】阿伏加德罗常数的值为NA。工业上,利用乙烯水化法制乙醇:CH2=CH2+H2O![]() CH3CH2OH。下列有关说法正确的是
CH3CH2OH。下列有关说法正确的是
A. 1mol乙烯和1mol乙醇分别完全燃烧,消耗O2的分子数均为3NA
B. 1mol H2O和H2F+的混合物中所含质子数为10NA
C. 乙醇催化氧化生成1mol乙醛时转移电子数为NA
D. 46g乙醇中所含共价键的数目为7NA
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于生物体内化合物的说法不正确的是( )
A. 脂肪是既能贮能又具有保温作用的物质
B. 蛋白质是控制细胞生命活动的大分子
C. 无机盐离子可以维持内环境的渗透压
D. 核酸承担了遗传信息贮存和传递的任务
查看答案和解析>>
科目: 来源: 题型:
【题目】反应4A(s)+3B(g)═2C(g)+D(g),经2min,B的浓度减少0.6mol/L.对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol(Lmin)﹣1
B.分别用B,C,D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol(Lmin)﹣1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组同学利用下图所示装置进行铁的电化学腐蚀原理的探究实验:
装置 | 分别进行的操作 | 现象 |
| i. 连好装置一段时间后,向烧杯中滴加酚酞 | |
ii. 连好装置一段时间后,向烧杯中滴加K3[Fe(CN)6]溶液 | 铁片表面产生蓝色沉淀 |
(1)小组同学认为以上两种检验方法,均能证明铁发生了吸氧腐蚀。
①实验i中的现象是________________________________。
②用化学用语解释实验i中的现象:________________________________。
(2)查阅资料:K3[Fe(CN)6]具有氧化性。
①据此有同学认为仅通过ii中现象不能证明铁发生了电化学腐蚀,理由是_____________________。
②进行下列实验,在实验几分钟后的记录如下:
实验 | 滴管 | 试管 | 现象 |
| 0.5 mol·L-1K3[Fe(CN)6]溶液 | iii. 蒸馏水 | 无明显变化 |
iv. 1.0 mol·L-1NaCl溶液 | 铁片表面产生大量蓝色沉淀 | ||
v. 0.5 mol·L-1 Na2SO4溶液 | 无明显变化 |
a. 以上实验表明:在条件下____________,K3[Fe(CN)6]溶液可以与铁片发生反应。
b. 为探究Cl-的存在对反应的影响,小组同学将铁片酸洗(用稀硫酸浸泡后洗净)后再进行实验iii,发现铁片表面产生蓝色沉淀。此补充实验表明Cl-的作用是____________________。
(3)有同学认为上述实验仍不严谨。为进一步探究K3[Fe(CN)6]的氧化性对实验ii结果的影响,又利用(2)中装置继续实验。其中能证实以上影响确实存在的是___________(填字母序号)。
实验 | 试剂 | 现象 |
A | 酸洗后的铁片、K3[Fe(CN)6]溶液(已除O2) | 产生蓝色沉淀 |
B | 酸洗后的铁片、K3[Fe(CN)6]和NaCl混合溶液(未除O2) | 产生蓝色沉淀 |
C | 铁片、K3[Fe(CN)6]和NaCl混合溶液(已除O2) | 产生蓝色沉淀 |
D | 铁片、K3[Fe(CN)6]和盐酸混合溶液(已除O2) | 产生蓝色沉淀 |
(4)综合以上实验分析,利用实验ii中试剂能证实铁发生了电化学腐蚀的实验方案是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com