
科目: 来源: 题型:
【题目】恒温下,将amolN2与bmH2的混合气体通入一个固定容积的密闭容器中,发生如下反应:N2(g)+3H2(g) ![]() 2NH3(g)。
2NH3(g)。
(1)若反应进行到某时刻t时,nt(N2)=13mol,nt(NH3)=6mol,计算a的值__________。
(2)反应达平衡时,混合气体的体积为716.8L(标准状况下),其中NH3的含量(体积分数为25%。计算平衡时NH3的物质的量为_________________。
(3)原混合气体与平衡混合气体的总物质的量之比(写最简整数比,下同),n(始):n(平)=______。
(4)原混合气体中,a:b=______________。
(5)达到平衡时,N2和H2的转化率之比,a(N2):a(H2)=_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据表中信息判断,下列选项不正确的是( )
序号 | 反应物 | 产物 |
① | KMnO4、H2O2、H2SO4 | K2SO4、MnSO4 |
② | Cl2、FeBr2 | FeCl3、FeBr3 |
③ | MnO | Cl2、Mn2+ |
A. 第①组反应的其余产物为H2O和O2
B. 第②组反应中参加反应的Cl2与FeBr2的物质的量之比为1∶2
C. 第③组反应中生成1 mol Cl2,转移电子 2 mol
D. 氧化性由强到弱顺序为MnO![]() >Cl2>Fe3+>Br2
>Cl2>Fe3+>Br2
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置可以测定铜锌原电池工作时转移电子的物质的量,假设量筒的量程足够大,锌片和 铜片中无杂质,气体体积已转换为标准状况。下列说法正确的是 ( )

A. a 电极的电极材料是铜
B. 如果将稀硫酸换为 CuSO4 溶液,则不能达到实验目的
C. 锌与稀硫酸反应时放出的热量对实验测定不产生影响
D. 若量筒中收集到 a L H2,则电解质溶液中通过了![]() mol 电子
mol 电子
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,取pH=2的两种二元酸H2A和H2B各1mL,分别加水稀释,测得溶液pH与加水稀释倍数关系曲线如图所示,则下列叙述正确的是( ) 
A.H2A的电离方程式为H2AH++HA﹣、HA﹣H++A2﹣
B.pH=4的NaHA水溶液中:c(Na+)>c(HA﹣)>c(A2﹣)>c(H2A)>c(OH﹣)
C.含NaHA,NaHB的混合溶液中,各离子浓度关系为c(Na+)=c(A2﹣)+c(HB﹣)+c(H2B)+c(B2﹣)
D.NaHB水溶液中,各离子浓度的大小顺序为c(Na+)>c(HB﹣)>c(OH﹣)>c(H+)>c(B2﹣)
查看答案和解析>>
科目: 来源: 题型:
【题目】有关物质的转化关系如图所示(部分物质与条件己略去).A是最常见的无色液体,B、C是常见的金属单质,D、E是气体单质,且D在空气中的含量最多,F 是一种具有磁性的化合物,H是既能与强酸反应又能与强碱反应的氧化物:I具有耐高温、抗冲击、导热性好的优良性质,广泛应用于电子工业、陶瓷工业中. 
请回答下列问题:
(1)H的化学式为 .
(2)D 的电子式为 .
(3)K出反应①的化学方程式: .
(4)写出G的水溶液与C的硝酸盐溶液反应的方程式: .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关化合物的说法正确的是( )
A.干冰的主要成分是H2O
B.SO2可大量用于漂白食品
C.吸入CO可导致人体中毒
D.小苏打的主要成份是Na2CO3
查看答案和解析>>
科目: 来源: 题型:
【题目】某课题组以苯为主要原料,采用以下路线合成利胆药——柳胺酚。

已知:
回答下列问题:
(1)写出A→B反应所需的试剂____________, A→B反应类型为__________。
(2)对于柳胺酚,下列说法正确的是________。
A.1 mol柳胺酚最多可以和2 mol NaOH反应 B.可发生水解反应
C.不能发生硝化反应 D.可与溴发生取代反应
(3)写出B→C的化学方程式___________________________________________。
(4)写出化合物F的结构简式______________________
(5)写出同时符合下列条件的F的同分异构体的结构简式_____________________________________(写出3种)。
①属酚类化合物,且苯环上有三种不同化学环境的氢原子;②能发生银镜反应
(6)以苯和乙烯为原料可合成聚苯乙烯,请设计合成路线(无机试剂及溶剂任选)。_______________________
注:合成路线的书写格式参照如下示例流程图:CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目: 来源: 题型:
【题目】研究CO2的利用对促进低碳社会的构建具有重要的意义。
(1) 在一定条件下将CO2 和H2转化为甲醇蒸气和水蒸气的相关反应有:
CO2(g) +H2(g)![]() CO(g)+H2O(g) △H1=+41KJ/mol
CO(g)+H2O(g) △H1=+41KJ/mol
CO(g) +2H2(g)![]() CH3OH(g) △H2=-90KJ/mol
CH3OH(g) △H2=-90KJ/mol
则由CO2和H2转化为甲醇蒸气和水蒸气的热化学方程式为_____________________________________。
(2)在一定温度下,向2L固定容积的密闭容器中通入2molCO2、3molH2,发生反应CO2(g) +3H2(g)![]() CH3OH(g) +H2O(g) △H3<0。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
CH3OH(g) +H2O(g) △H3<0。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示。
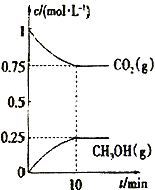
①能说明该反应已达平衡状态的是________________________。
A.单位时间内有3n molH-H键断裂,同时又有2n mol O-H键断裂
B.混合气体的密度不随时间变化
C.体系中n(CO2)/n(H2)=1∶1,且保持不变
D. CO2的体积分数在混合气体中保持不变
②下列措施能使n(CH3OH)/n(CO2)增大的是_______________。
A.升高温度 B.恒温恒容下,再充入2molCO2、3molH2
C.使用高效催化剂 D.恒温恒容充入He使体系压强增大
③计算该温度下此反应的平衡常数K=_________(保留3位有效数字);若使K的值变为1,则应采取的措施是___________________________。
A.增大压强 B.恒压加入一定量H2 C. 升高温度 D. 降低温度
(3)捕捉CO2可以利用Na2CO3溶液。用100mL 0.1mol/LNa2CO3溶液完全捕捉0.44gCO2气体(溶液体积变化不变),所得溶液中c(HCO3-)+c(CO32-)+c(H2CO3)=________ mol/L
(4)被誉为改变未来世界的十大科技之一的燃料电池是一种新型的无污染、无噪音、高效率的汽车动力和发电设备,正以势不可挡之势挤入汽车工业和电力工业。写出甲醇燃料电池碱性电解质(铂为两极。电解液为KOH 溶液)的负极电极反应:___________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】井水冒泡、有异味和变浑浊是地震的常见征兆,其中可能涉及地下硫铁矿(FeS2)发生的反应:FeS2+H2O═Q+S+H2S↑ (已配平),则物质Q是( )
A.Fe2O3
B.FeO
C.Fe(OH)2
D.Fe(OH)3
查看答案和解析>>
科目: 来源: 题型:
【题目】2Zn(OH)2·ZnCO3是制备活性ZnO的中间体,以锌焙砂(主要成分为ZnO,含少量Cu2+、Mn2+等离子)为原料制备2Zn(OH)2·ZnCO3的工艺流程如下:
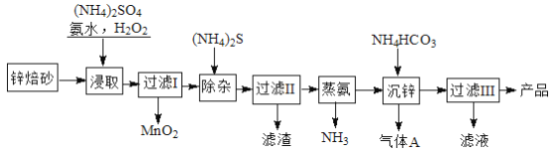
请回答下列问题:
(1)当(NH4)2SO4,NH3·H2O的混合溶液中存在c(NH4+)=2c(SO42-)时,溶液呈___________ (填“酸”、“碱”或“中”)性。
(2)“浸取”时为了提高锌的浸出率,可采取的措施是__________________(任写一种)。
(3)“浸取”时加入的NH3·H2O过量,生成MnO2的离子方程式为____________________________。
(4)“沉锌”的离子方程式为__________________________________。
(5)“过滤III”所得滤液可循环使用,其主要成分的化学式是__________________。
(6)己知:HCN的电离常数Ka=4.9×10 -10, H2S 的电离常数Ka1=1.3×10 -7,Ka2=7.0×10 -15,向NaCN 溶液中通入少量的H2S 气体,反应的离子方程式为______________________________________。在废水处理领域中常用H2S 将Mn2+转化为MnS 除去,向含有0.020 molL-1Mn2+废水中通入一定量的H2S 气体,调节溶液的pH=a,当HS-浓度为1.0×10 -4molL-1时,Mn2+开始沉淀,则a=____________。[已知: Ksp(MnS)=1.4×10 -15]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com