
科目: 来源: 题型:
【题目】某探究小组设计如右图所示装置(夹持、加热仪器略),模拟工业生产进行制备三氯乙醛(CCl3CHO)的实验。查阅资料,有关信息如下:
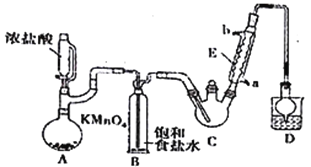
①制备反应原理:C2H5OH+4Cl2→CCl3CHO+5HCl
可能发生的副反应: C2H5OH+HCl→C2H5Cl+H2O;
CCl3CHO+HClO→CCl3COOH(三氯乙酸)+HCl
②相关物质的部分物理性质:
C2H5OH | CCl3CHO | CCl3COOH | C2H5Cl | |
相对分子质量 | 46 | 147.5 | 163.5 | 64.5 |
熔点/℃ | -114.1 | -57.5 | 58 | -138.7 |
沸点/℃ | 78.3 | 97.8 | 198 | 12.3 |
溶解性 | 与水互溶 | 可溶于水、乙醇 | 可溶于水、乙醇 三氯乙醛 | 微溶于水,可溶于乙醇 |
(1)仪器A中发生反应的化学方程式为_________________________________。
(2)装置B的作用是_________________。该实验在装置中有一处缺陷,即缺少氯气的干燥裝置,缺少该装置可能导致装置C 中副产物______________(填化学式)的量增加;冷凝管的进水口是________(填“a”或“b”);
(3)装置中球形冷凝管的作用是______________________,写出D中所有可能发生的无机反应的离子方程式___________________________________。
(4)反应结束后,从C中的混合物中分离出CCl3COOH的方法是_________________________。
(5)测定产品纯度:称取产品0.50g配成待测溶液,加0.1000 molL-1碘标准溶液20.00 mL,再加入适量Na2CO3溶液,反应完全后,加盐酸调节溶液的pH,立即用0.02000 molL-1Na2S2O3溶液滴定至终点。进行三次平行实验,测得消耗Na2S2O3溶液20.00mL。则产品的纯度为_____________;(计算结果保留两位有效数字)滴定的反应原理:CCl3CHO+OH-==CHCl3span>+HCOO- HCOO-+I2== H++2I-+CO2↑ I2+2S2O32-==2I-+ S4O62-
(6)为证明三氯乙酸的酸性比乙酸强。某学习小组的同学设计了以下三种方案,你认为能够达到实验目的的是___________。
a.分别测定0.1mol·L-1两种酸溶液的pH,三氯乙酸的pH 较小
b.用仪器测量浓度均为0.1mol·L-1 的三氯乙酸和乙酸溶液的导电性,测得乙酸溶液的导电性弱
c.测定等物质的量浓度的两种酸的钠盐溶液的pH,乙酸钠溶液的pH 较大
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律.下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089nm).
元素代号 | A | B | C | D | E | F | G |
原子半径/nm | 0.037 | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 | 0.075 |
主要化合价 | +1 | +2 | +3 | +6、-2 | -1 | -2 | +5、-3 |
(1)C元素在元素周期表中的位置是 ______ ;
(2)B的原子结构示意图为 ______ ;
(3)D、E气态氢化物的稳定性强弱顺序为 ______ (填化学式);
(4)上述七种元素的最高价氧化物对应水化物中酸性最强的是 ______ (填化学式);
(5)以C为材料制成的容器不能贮存强碱溶液,用离子方程式表示其原因为: ______ ;
(6)碲(52Te)的某化合物是常用的VCR光盘记录材料之一,可在激光照射下发生化学或物理的性能改变而记录、储存信号.推测碲元素在周期表中的位置,则碲元素及其化合物可能具有的性质为:______ ;
A.单质碲在常温下是固体B.Cl2通入H2Te溶液中不发生反应
C.H2Te不如HI稳定 D.H2TeO4的酸性比H2SO4的弱
查看答案和解析>>
科目: 来源: 题型:
【题目】无色透明的酸性溶液中能大量共存的离子组是
A.K+、HCO3-、Cl-B.Fe2+、Cu2+、SO42-
C.Na+、SO42-、ClO-D.Mg2+、NH4+、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氯气的叙述正确的是
A.铁丝在氯气中燃烧生成FeCl2
B.红热的铜丝在氯气中剧烈燃烧,产生棕黄色的烟
C.氯气、液氯和氯水都是纯净物,都有漂白性
D.用氯气对生活用水进行消毒的原因是氯气本身能杀灭细菌
查看答案和解析>>
科目: 来源: 题型:
【题目】电导率可用于衡量电解质溶液导电能力的大小,且电导率越大溶液的导电能力越强。室温下 ,用0.l00 mol·L-1的NH3· H2O 滴定10 .00mL 浓度均为0 . 100 mol·L-1HCl和CH3COOH的混合液,电导率曲线如图所示。下列说法正确的是
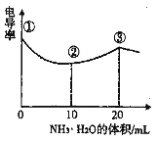
A.① 溶液中c(H +)为0 . 200 mol·L-1
B.溶液温度高低为① >③ >②
C.③ 点后因离子数目减少使电导率略降低
D.③ 点时溶液中有c ( C1一)>(CH3 COO一)
查看答案和解析>>
科目: 来源: 题型:
【题目】全球海水中溴的储藏量丰富,约占地球溴总储藏量的99%,故溴有“海洋元素”之称,海水中溴含量为65 mg·L-1。空气吹出SO2吸收法工艺流程如下:

(1)步骤③的离子方程式: _________________________________________________。
(2)步骤⑤中溴蒸气冷凝后得到液溴与溴水的混合物,可利用它们的相对密度相差很大的特点进行分离。分离仪器的名称是________。
(3)溴水混合物Ⅱ中溶有一定量的氯气,因此在步骤⑤中可将蒸馏产生的气体通过________(填试剂名称)溶液,以除去氯气。
(4)步骤⑤的蒸馏过程中,温度应控制在80~90 ℃。温度过高或过低都不利于生产,请解释原因______________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化工生产中含Cu2+的废水常用MnS(s)作沉淀剂,其反应原理为: Cu2+(aq)+MnS(s)CuS(s)+Mn2+(aq)
下列有关该反应的推理不正确的是( )
A.该反应达到平衡时:c(Cu2+)=c(Mn2+)
B.CuS的溶解度比MnS的溶解度小
C.往平衡体系中加入少量Cu(NO3)2(s)后,c(Mn2+)变大
D.该反应平衡常数表达式:K= ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】海水中有取之不尽的化学资源,从海水中可提取多种化工原料。如图是某工厂综合利用海水资源的示意图。

试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得饱和NaCl溶液。精制过程中所用试剂有a、BaCl2溶液、b、Na2CO3溶液、c、 NaOH溶液、d、盐酸。加入试剂顺序正确的是____________;
A、a.b.c.d B、c.b.a.d C、b.a.d.c D、a.c.b.d
(2)写出电解饱和食盐水方程式________________________________________,产生的Cl2和烧碱反应能生成____________(填商品名称),反应方程式________。
(3)海水中提取食盐后的母液中含有K+、Na+、Mg2+等。从离子反应的角度考虑,向母液中加入石灰乳的作用是_________________________。
(4)电解熔融的氯化镁所得的镁蒸气冷却后即为固体镁,可以冷却镁蒸气的气体氛围为_____。
A.H2 B.CO2 C.空气 D.Ar
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com