
科目: 来源: 题型:
【题目】1981年,Thoms Cech在研究四膜虫时,发现其rRNA前体加工除去某些片段的过程中发生“剪接反应”,该反应是在仅有RNA没有任何蛋白质参与的情况下完成的。下列推论最合理的是( )
A.该反应不需要酶的催化 B.四膜虫体内的这种RNA具有酶的特性
C.所有蛋白质和RNA都是酶 D.有的DNA也可能是酶
查看答案和解析>>
科目: 来源: 题型:
【题目】C、H、N三种元素在人体的化学成分中,质量分数共占73%左右,而在岩石圈的化学成分中,质量分数不到1%,这一事实说明( )
A. 生物界与非生物界具有相似性
B. 生物界与非生物界具有统一性
C. 生物界与非生物界具有差异性
D. 生物界和非生物界的本质完全相同
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题: I.将等物质的量的A、B混合放于2L的密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g).经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,v(C)=0.1mol/(Lmin).则:
(1)x= .
(2)前5min内B的反应速率v(B)= .
(3)平衡时A的转化率为 .
(4)II.水蒸气通过炙热的碳层发生反应:C(s)+H2O(g)CO(g)+H2(g)△H. 已知:K(300℃)<K(350℃),则该反应是热反应.
(5)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号. 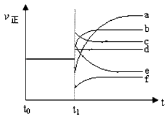
①缩小容器体积; ②降低温度
(6)已知反应①CO(g)+CuO(g)CO2(g)+Cu(s)②H2(g)+CuO(g)Cu(s)+H2O(g) 在相同的某温度下的平衡常数分别为K1和K2 , 该温度下反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=(用K1和K2表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用菱锰矿(MnCO3)[含FeCO3、SiO2、Cu2(OH)2CO3等杂质]为原料制取二氧化锰,其流程示意图如下:
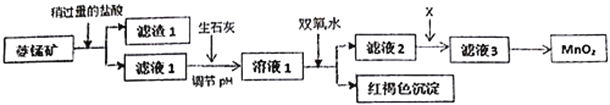
已知:生成氢氧化物沉淀的pH
Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
Ksp(CuS)=6.3×10-16 Ksp(MnS)= 3×10-14
注:金属离子的起始浓度为0.1 mol/L
回答下列问题:
(1)含杂质的菱锰矿使用前需将其粉碎,主要目的是_________________________。滤渣1的成分是_________,盐酸溶解MnCO3的离子方程式是_________________________________;
(2)用生石灰而不用NaOH调节pH的原因是_______________________________;
(3)滤液2中加入某种物质X可以除去Cu2+,最适合的是_______________;
A.MnO2 B.NaOH C.MnS
该反应的离子方程式是____________________________;
(4)将MnCl2转化为MnO2的一种方法是将酸化的NaClO3溶液氧化Mn2+,请补充并配平下列方程;____Mn2++_____ClO3-+______=____Cl2↑+____MnO2+_________;_________________
(5)将MnCl2转化为MnO2的另一种方法是电解法。(填“正极”或“负极”或“阴极”或“阳极”)
① MnO2在电解池的__________________(填“正极”或“负极”或“阴极”或“阳极”)生成;
② 若直接电解MnCl2溶液,生成MnO2的同时会产生少量Cl2。检验Cl2的操作是_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。
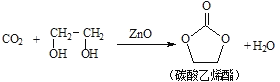
回答下列问题:
(1)锌基态离子的价电子排布图为_______________;在基态18O原子中,核外电子存在_________种空间运动状态。
(2)乙二醇中C、H、O的电负性大小关系是__________ ;碳酸乙烯酯中碳原子的杂化轨道类型有___________;1mol 碳酸乙烯酯中含有的σ键的数目为__________NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是_________(填微粒符号),[Zn(H2O)6]2+中所含化学键的类型为__________________________。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______________。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为_________;若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______g·cm-3(用NA表示阿伏加德罗常数的值,列出算式不要求结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫有多种含氧酸,在工业上有广泛的应用,其钠盐同样也是重要的化工产品。
Ⅰ.硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上常利用含硫废水生产Na2S2O3·5H2O,实验室可用如下装置模拟生成过程:

烧瓶C中发生反应如下:
Na2S(aq)+H2O(l)+SO2(g)==NaSO3(aq)+H2S(aq)(Ⅰ)
2H2S(aq)+SO2(g)=3S(s)+2H2O(l)(Ⅱ)
S(s)+Na2SO3(aq) ![]() Na2S2O3(aq)(Ⅲ)
Na2S2O3(aq)(Ⅲ)
(1)烧瓶A中发生反应的离子方程式为_________________________________。装置D的作用是__________________________。
(2)装置B的作用之一是观察SO2的生成速率,其中的液体最好选择_____________。
a.蒸馏水 b.饱和Na2SO3溶液 c.饱和NaHSO3溶液 d.饱和NaHCO3溶液
(3)反应后期可用酒精灯适当加热烧瓶A,实验室用酒精灯加热时必须使用石棉网的仪器还有______
a.烧杯 b.燕发皿 c.试管 d.锥形瓶
(4)为了保证Na2S2O3的产量,实验中通入SO2不能过量,原因是_____________________。
Ⅱ.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。(Na2S2O5溶于水即生成NaHSO3。
(5)证明NaHSO3溶液中HSO3-电离程度大于水解程度,可采用的实验方法有________________。
a.测定溶液的pH b.加入Ba(OH)2溶液 c. .加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定菜葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI):
![]()
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为______g/L
②在上述实验过程中,HI可能会被空气氧化,反应的化学方程式为_____________________________。若有部分HI被空气氧化,会导致测得的结果_______(填“偏高”“ 偏低”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】高炉煤气是炼铁厂排放的尾气,含有H2、N2、CO、CO2及O2,其中N2约为55%、CO约为25%、CO2约为15%、O2约为1.64% (均为体积分数)。某科研小组对尾气的应用展开研究:
I.直接作燃料
己知:C(s)+O2(g)=CO2 (g) △H=-393.5kJ/mol
2C(s)+O2(g)=2CO (g) △H=-221kJ/mol
(1)CO燃烧热的热化学方程式为____________________________________________________________________________ 。
II.生产合成氨的原料
高炉煤气经过下列步骤可转化为合成氨的原料气:
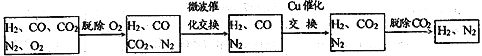
在脱氧过程中仅吸收了O2;交换过程中发生的反应如下,这两个反应均为吸热反应:CO2+CH4![]() CO+H2 CO+H2O
CO+H2 CO+H2O![]() CO2+ H2
CO2+ H2
(2)气体通过微波催化交换炉需要较高温度,试根据该反应特征,解释采用较高温度的原因:____________________________________________________________________________ 。
(3)通过铜催化交换炉后,所得气体中V(H2):V(N2)= ______________。
III.合成氨后的气体应用研究
(4)氨气可用于生产硝酸,该过程中会产生大气污染物NOx。为了研究对NOx的治理,该科研小组在恒温条件下,向2L恒容密闭容器中加入0.2molNO 和0.1molCl2,发生如下反应:2NO(g)+Cl2(g)![]() 2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5
2ClNO(g) △H<0。10min时反应达平衡,测得10min 内v (ClNO)=7.5![]() 10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
10-3mol/(L·min),则平衡后n(Cl2)=_________mol。
设此时NO的转化率为α1,若其它条件不变,上述反应在恒压条件下进行,平衡时NO 的转化率为α2,则α1 ____α2 (填“>”、“<”或“=”);平衡常数K____ (填增大”“减小 ”或“不变”)
(5)氨气还可用于制备NCl3,NCl3发生水解产物之一具有强氧化性,该水解产物能将稀盐酸中的NaClO2氧化成ClO2,该反应的离子方程式为_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com