
科目: 来源: 题型:
【题目】工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)CH3OH(g)
(1)判断反应达到平衡状态的依据是(填字母序号,下同) .
A.生成CH3OH的速率与消耗CO的速率相等
B.混合气体的密度不变
C.混合气体的相对平均分子质量不变
D.CH3OH、CO、H2的浓度都不再发生变化
E.气体的压强不再改变
(2)表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为 .
(3)要提高CO的转化率,可以采取的措施是 .
a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容下加入H2使压强变大
e.恒容下加入惰性气体使压强变大 f.分离出甲醇
(4)在250℃时,测得某密闭容器中各物质的物质的量浓度见表:
CO | H2 | CH3OH |
0.5molL﹣1 | 2molL﹣1 | 6molL﹣1 |
此时反应的正、逆反应速率的关系是:v(正)v(逆)(填“>”“<”或“═”).
查看答案和解析>>
科目: 来源: 题型:
【题目】在实验室中用二氧化锰跟浓盐酸反应制备干燥纯净的氯气。进行此实验,所用仪器如下图:
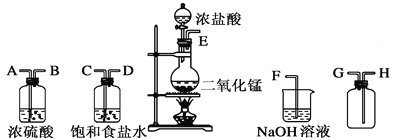
(1)连接上述仪器的正确顺序(填各接口处的字母):____接____;____接____;____接____;____接____。
(2)装置中,饱和食盐水的作用是__________________________;
(3)化学实验中常用湿润的淀粉-KI试纸检验是否有Cl2产生。如果有Cl2产生,可观察到________,反应方程式__________________。
(4)写出下列化学反应的方程式:
①气体发生装置进行的反应:______________。②NaOH溶液中发生的反应:_____________。
(5)KMnO4的氧化性比MnO2强得多,实验室也可以用KMnO4固体和浓盐酸反应制取氯气,反应方程式如下:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O。
①请用“单线桥”标出电子转移的方向和数目_________;
②该反应中被氧化和未被氧化的HCl的物质的量之比是________,如果将20 mL、12 mol·L-1的浓盐酸与足量KMnO4充分反应,实际能收集到的氯气在标准状况下的体积将________。
A.≥1.68 L B.>1.68 L C.≤1.68 L D.<1.68 L
查看答案和解析>>
科目: 来源: 题型:
【题目】下列生活生产中常见的物质里含有的有机物属于高分子化合物的是( )
A.蜂蜜中含有的葡萄糖
B.石油中含有的C16H34
C.芹菜中含有的纤维素
D.植物油中含有的油脂
查看答案和解析>>
科目: 来源: 题型:
【题目】铀(U)是一种稀有金属,制造氢弹的重要原料。提取铀涉及的反应为:UF4+ 2Mg![]() U + 2MgF2。在该反应中,作为还原剂的物质是______,被还原的物质是______;若反应中消耗1 mol Mg,则生成U______mol。
U + 2MgF2。在该反应中,作为还原剂的物质是______,被还原的物质是______;若反应中消耗1 mol Mg,则生成U______mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】废旧印刷电路板的回收利用可实现资源再生,并减少污染.
(1)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.已知:
Cu(s)+2H+(aq)=Cu2+(aq)+H2(g)△H=+64.39kJmol﹣1
2H2O2(l)=2H2O(l)+O2(g)△H=﹣196.46kJmol﹣1
H2(g)+ ![]() O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
O2(g)=H2O(l)△H=﹣285.84kJmol﹣1
在 H2SO4溶液中Cu与H2O2反应生成Cu2+和H2O的热化学方程式为 .
(2)控制其他条件相同,印刷电路板的金属粉末用10%H2O2和3.0mol/LH2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见表).
温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是 .
(3)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)在25℃、101kPa下,8g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出176kJ的热量,则表示甲醇燃烧热的热化学方程式为 .
(2)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关.
已知:H2 (g)+Cl2 (g)=2HCl (g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= ,
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体.在25℃、101kPa下,已知该反应每消耗1mol CuCl(s),放热44.4kJ,该反应的热化学方程式是 .
(4)FeCO3在空气中加热反应可制得铁系氧化物材料.
已知25℃,101kPa时:4Fe(s)+3O2(g)=2Fe2O3(s)△H=﹣1648kJ/mol
C(s)+O2(g)=CO2(g)△H=﹣393kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)△H=﹣1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】铁被誉为“第一金属”,铁及其化合物广泛应用于生活、生产、国防等领域。
(1)Fe2+是构成人体血红蛋白(如图1所示)的重要元素,基态Fe2+简化的电子排布式为___________;用物质结构与性质知识分析Fe2+在空气中容易被氧化成Fe3+的主要原因:_________________________________________。
(2)血红蛋白中所含非金属元素的电负性由小到大的顺序为___________;碳原子的杂化轨道类型为__________________杂化。
(3)羰基铁[Fe(CO)5]可用作催化剂等。1mol[Fe(CO)5]分子中含有____mol的σ键,与CO互为等电子体的离子的化学式为___________________________(写一种)。
(4)据报道,工业上可电解熔融的FeO、Fe2O3冶炼高纯铁。Fe2O3的熔点____________(填“高于”或“低于”) FeO的熔点,理由是____________________________________________。
(5)铁晶体有面心立方、体心立方。在这两种晶体中铁的配位数之比为______________。
(6)某种氮化铁晶体的晶胞如图2所示。已知:该晶胞边长、高分别为anm、bnm,NA=6.02×1023mol-l
①该氮化铁晶体的化学式为______________。
②列式表示该氮化铁晶体的密度_________________________________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列过程不涉及化学变化的是
A.利用粮食酿酒经过了淀粉→葡萄糖→乙醇的变化过程
B.苯加入溴水振荡、静置,溴水褪色
C.植物油氢化得到人造脂肪
D.氢氧燃料电池放电时化学能转化为电能
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com