
科目: 来源: 题型:
【题目】某工厂用含NH4+废水处理工业废气(其化学成分为CO2、SO2、NO,不考虑其他成分)的工艺流程如下:

(1)固体1的主要成分为Ca(OH)2、___________。
(2)气体2无毒性,写出处理含NH4+废水时所发生反应的离子方程式:_________________________。
(3)查阅资料可知:向2mol气体1中通入不同量的O2,并将所得混合气体通入NaOH溶液中,有关含氮组分的物质的量变化如图所示。

上述工艺流程中气体1与O2的体积比(相同条件)应控制为_____________________________。
(4)为测定上述流程中所得NaNO2溶液的物质的量浓度,准确量取10.00mLNaNO2溶液样品与24.00mL0.05mol/L过量的酸性KMnO4溶液充分反应,反应后所得溶液用0.1mol/L(NH4)2Fe(SO4)2标准溶液滴定至紫色刚好褪去,消耗(NH4)2Fe(SO4)2溶液10.00mL。
通过计算确定NaNO2溶液的物质的量浓度(写出计算过程)。_________________
查看答案和解析>>
科目: 来源: 题型:
【题目】牛通过吃草从草中获得化合物和元素,那么,牛和草体内的各种化学元素( )
A.种类差异很大,含量大体相同
B.种类和含量差异都很大
C.种类和含量都是大体相同的
D.种类大体相同,含量差异很大
查看答案和解析>>
科目: 来源: 题型:
【题目】阿塞那平用于治疗精神分裂症,可通过以下方法合成(部分反应条件略去);

(1)阿塞那平中的含氧官能团为_______(填官能团的名称)。由F→阿塞那平的反应类型为______________。
(2)化合物X的分子式为C4H9NO2,则由B→C反应的另一产物的化学式_______________________。
(3)由D生成E的过程中先后发生加成反应和消去反应,则加成反应后中间体的结构简式为____________。
(4)写出同时满足下列条件的B的一种同分异构体的结构简式:________。
I.属于芳香化合物,分子中含有5种不同化学环境的氢;
II.能发生银镜反应和水解反应,水解产物能与FeCl3溶液发生显色反应。
(5)已知: ![]() ,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、CH3NH2和
,卤代烃碱性条件下不与醇反应。请写出以CH3Cl、CH3NH2和![]() 为原料制备
为原料制备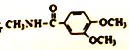 的合成路线流程图(无机试剂任用)。_____________
的合成路线流程图(无机试剂任用)。_____________
查看答案和解析>>
科目: 来源: 题型:
【题目】以镍矿粉(主要成分为NiS,杂质FeS、CuS和SiO2等)为原料可制备NiCO3
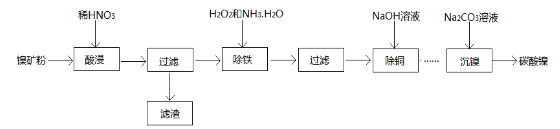
已知Ni和Fe为变价金属,常见化合价为+2价、+3价。
(1)在酸浸过程中,CuS与稀HNO3反应生成淡黄色固体,其离子方程式为___________________,滤渣的主要成分为________________________;
(2)在除FeS时,需加入过量的H2O2氧化,若用过强的氧化剂,其可能的后果是_______________;反应完全后,除去多余H2O2的简便方法是______________________;
(3)在“沉镍”工艺中,若将含Ni2+溶液缓慢加入至盛有Na2CO3溶液的反应容器中,可能会形成杂质,其原因是_______________________(用离子方程式表示)。检验碳酸镍沉淀完全的方法是__________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组设计了如下实验,探究常温下催化剂对过氧化氢分解反应的影响。
Ⅰ | Ⅱ | Ⅲ | |
实验操作 示意图 |
|
|
|
实验现象 | 有极少量气泡产生 | 产生气泡速率略有加快 | 产生气泡速率明显加快 |
(1)实验Ⅰ的作用是_______________。
(2)实验Ⅲ中反应的化学方程式为_______________。
(3)根据实验Ⅰ~Ⅲ中现象的不同,可以得出的结论是:
①使用合适的催化剂,可提高双氧水分解的反应速率;
②_______________。
(4)在一定温度下,10 mL 0.40 mol/L,H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表所示:
t/min | 0 | 2 | 4 | 6 | 8 | 10 |
V(O2)/mL | 0 | 9.9 | 17.2 | 22.4 | 26.5 | 29.9 |
0~6 min,以H2O2的浓度变化表示的反应速率为v(H2O2)=_________mol/(L·min)。(计算结果精确到0.001)
查看答案和解析>>
科目: 来源: 题型:
【题目】700℃时,向容积为2L的密闭容器中充入一定量的CO和H2O,发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是
CO2(g)+H2(g),反应过程中测定的部分数据见下表(表中t1<t2),下列说法正确的是
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 1.2 | 0.60 |
t1 | 0.80 | |
t2 | 0.20 |
A. 反应在t1min内的平均速率为v(H2)=0.40/t1mol/(L·min)
B. 温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
C. 保持其他条件不变,起始时向容器中充入0.60molCO和1.20molH2,到达平衡时,n(CO2)=0.40mol
D. 保持其他条件不变,向平衡体系中再通入0.20molCO,与原平衡相比,达到新平衡时CO转化率减小,H2O的体积分数也减小
查看答案和解析>>
科目: 来源: 题型:
【题目】已知常温下CH3COOH和NH3·H2O的电离平衡常数分别为Ka、Kb。若在常温下向0.1mol/L的醋酸溶液中逐滴加入相同浓度的氨水直至完全过量,则下列说法正确的是
A. 加入氨水的过程中,溶液的导电性一直不断增强
B. CH3COONH4在水溶液中的水解平衡常数Kh=Kw/(Ka+Kb)
C. 若Ka≈Kb,当加入等体积的氨水时,溶液基本呈中性
D. 该等式在滴加过程中始终成立c(CH3COO-)+c(CH3COOH)=c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,在一恒容密闭容器中,能表示反应 X(g)+2Y(g)2Z(g) 一定达到化学平衡状态的是( )
①容器中气体的密度不再发生变化
②X、Y、Z的浓度不再发生变化
③容器中的压强不再发生变化
④单位时间内生成n mol Z,同时生成2n mol Y.
A.①②
B.②③
C.③④
D.①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com