
科目: 来源: 题型:
【题目】X、Y、Z、U、W 是原子序数依次增大的前四周期元素。其中 Y 的原子核外有 7 种运动状态不同的 电子;X、Z 中未成对电子数均为 2;U 是第三周期元素形成的简单离子中半径最小的元素;W 的内层电 子全充满,最外层只有 1 个电子。请回答下列问题:
(1)U 在周期表中的位置 。X、Y、Z 的第一电离能从大到小的顺序是 (用元素符号表示,下同)。
(2)写出 W 的价电子排布图 。
(3)根据等电子体原理,可知化合物 XZ 的电子式是 。
(4)X、Y、Z的最简单氢化物的键角从大到小的顺序是 ( 用化学式表示), 原因 是 。
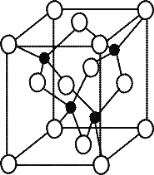
(5)由元素 Y 与 U 元素组成的化合物 A,晶胞结构如右图所示(黑球表示 Y 原子, 白球表示 U 原子),请写出化合物 A 的化学式 ,其中 Y 元素的杂化方式是 。
(6)U 的晶体属立方晶系,其晶胞边长为 405 pm,密度是 2.70 g/cm,通过计算确定 其晶胞的类型 (填简单立方堆积、体心立方堆积或面心立方最密堆 积)(已知:4053≈6.64×107)
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究性学习小组选用以下装置进行实验设计和探究(图中a、b、c均为止水夹):
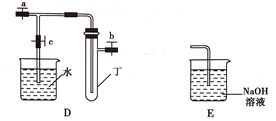
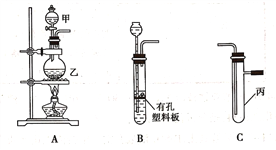
(1)在进行气体制备时,应先检验装置的气密性。将A装置中导管末端密封后,在分液漏斗甲内装一定量的蒸馏水,然后__________________________________________,则证明A装置的气密性良好。
(2)利用E装置能吸收的气体有__________________________________(任写两种即可)。
(3)用锌粒和稀硫酸制备H2时应选用装置________作为发生装置(填所选装置的字母序号),实验时先在稀硫酸中加入少量硫酸铜晶体可使反应速率加快,原因是___________________________。
(4)某同学将A、C、E装置连接后设计实验比较Cl-和S2-的还原性强弱。
①A中玻璃仪器乙的名称为______________________,A装置中发生反应的离子方程式为
_____________________________________________。
②C中说明Cl-和S2-的还原性强弱的实验现象是_______________________________________。
(5)另一同学将B、D、E装置连接后,在B装置中加入铜片和浓硝酸,制取NO2,然后进行NO2气体与水反应的实验,并观察相关现象:
①B装置中发生反应的离子方程式为________________________________________________。
②反应一段时间后D装置中的具支试管丁中收集满NO2气体,若进行NO2气体与水反应的实验,应____________________________________(填对a、b、c三个止水夹进行的操作),然后再适当加热丁。实验现象为____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】碳、氮和氯元素及其化合物与人类的生产、生活密切相关。
I.碳的化合物的转换在生产、生活中具有重要的应用。特别是CO2的低碳转型对抵御气候变化具有重要意义。

在三个容积均为1L的密闭容器中以不同的氢碳比n(H2)/n(CO2)充入H2和CO2,在一定条件下发生反应:
2CO2(g) + 6H2(g) ![]() C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
C2H4(g) + 4H2O(g) △H,CO2的平衡转化率与温度的关系如图所示(①、②、2.0分别代表三种氢碳比时的变化曲线)。
请回答下列问题:
(1)反应的△H_____0,氢碳比①________②,Q点v(正)_____v(逆)(填“大于”或“小于”)
(2)若起始时,CO2的浓度为0.5mol/L,氢气的浓度为1.0mol/L;则P点对应温度的平衡常数的值为_____________________。
II.氯的化合物合成、转化一直是科学研究的热点。
①一定条件下,氯气与氨气反应可以制备氯胺[NH2Cl(g)],已知部分化学键的键能:
则上述反应的热化学方程式为_______________________________________________________。
化学键 | N—H | Cl—Cl | N—Cl | H—Cl |
键能/kJ·mol-1 | 391.3 | 243.0 | 191.2 | 431.8 |
②氯胺是一种长效缓释含氯消毒剂,有缓慢而持久的杀菌作用,可以杀死H7N9禽流感病毒,其消毒原理为与水缓慢反应生成强氧化性的物质,该反应的化学方程式为
_________________________________________________________。
III.用氨水除去SO2
(1)已知25℃时,NH3·H2O的Kb=1.8×10-5,H2SO3的Ka1=1.3×10-2,Ka2=6.2×10-8.若氨水的浓度为2.0mol/L,则溶液中的c(OH-)=_________mol/L.将SO2通入该氨水中,当c(OH-)降至1.0×10-7mol/L时,溶液中的c(SO32-)/c(HSO3-)=_____________.
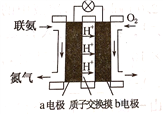
(2)利用氨气与空气催化氧化法制取联氨N2H4.如图是由“联氨-空气”形成的绿色燃料电池,以石墨为电极的电池工作原理示意图,b电极为____________极(填“正”或“负”),写出该电池工作时a电极的电极反应式___________________________________________.
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组利用废弃的铁铝混合物(含Fe、Al、Al2O3、Fe2O3)回收金属铝和铁,实验流程设计如下:
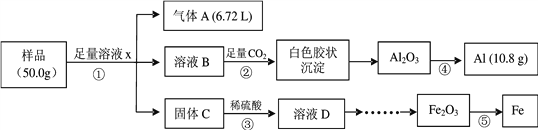
(1)写出①中发生反应的离子方程式___________、_____________。
(2)下列说法正确的是_________。
a. ②中发生的是非氧化还原反应
b. ③中所得溶液D中含有Fe2+和Fe3+
c. ④和⑤分别采用电解法和热还原法
(3)由溶液D制取Fe2O3的实验过程是 ______________。
(4)该样品中Al2O3的质量分数是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列装置由甲、乙部分组成(如图所示),甲是将废水中乙二胺[H2N(CH2)2NH2]氧化为环境友好物质形成的化学电源。当电池工作时,下列说法正确的是

A. 电子的流动方向M→Fe→CuSO4溶液→Cu-N
B. M极电极反应式: H2N(CH2)2NH2+16OH--16e-==2CO2↑+N2↑+12H2O
C. 当N极消耗5.6LO2时,则铁极增重32g
D. 一段时间后,乙中CuSO4溶液浓度基本保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】3,4-二羟基肉桂酸(H)是为止血升白细胞药,用于肿瘤治疗的术后恢复,其合成路线如图所示。

已知:
请回答下列问题:
(1)X的名称为_______________,A中的官能团的名称是____________。
(2)Y+R→Z的化学方程式为____________。反应类型为____________。
(3)下列说法正确的是____________ (填字母)。
a.1 molH最多能和3 mol Br2反应
b.1个H分子中最多有8个碳原子共平面
c.乙烯在一定条件下与水发生加成反应生成X
d.有机物Z的分子式为C9H8O2Cl2
(4)T是H的芳香族同分异构体,1mol T与足量碳酸氢钠溶液反应生成2mol CO2,则T的结构有____________种。其中,核磁共振氢谱有4组吸收峰,且峰面积比为1:2:2:3的结构简式为____________ (写一种即可)。
(5)设计以甲醛、Y为原料合成C5H12O4 ( )的路线 (无机试剂任选) 。____________
)的路线 (无机试剂任选) 。____________
查看答案和解析>>
科目: 来源: 题型:
【题目】第四周期有18种元素,其相关化合物在化工、医药、材料等领域均有着广泛的应用。请回答下列问题:
(1)基态钙原子核外电子云形状为____________,电子占据的最高能层符号是____________。
(2)五氧化二钒(V2O5)是硫酸工业中重要的催化剂,基态钒原子的价电子排布式为____________。
(3)琥珀酸亚铁片是用于缺铁性贫血的预防和治疗的常见药物,其中“亚铁”是关键成分,K3[Fe(CN)6]溶液是检验Fe2+的试剂,1molCN-中含π键的数目为____________,临床建议服用维生素C促进“亚铁”的吸收,避免生成Fe3+,从结构角度来看,Fe2+易被氧化成Fe3+的原因是____________。
(4)镓、锗、砷、硒的第一电离能由大到小的顺序为____________(用元素符号表示);其中锗的化合物四氯化锗可用作光导纤维渗杂剂,其熔点为-49.5℃,沸点为83.1℃,则其晶体类型为____________,中心原子的杂化类型为____________;砷酸酸性弱于硒酸,从分子结构的角度解释原因____________;砷化硼是一种新型材料,或成为最好的热导体,其结构与金刚石相似,已知砷化硼晶胞参数为bpm,则该晶体的密度为____________ g ·cm-3。(NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目: 来源: 题型:
【题目】木炭、活性炭、炭黑、焦炭是由石墨的微小晶体和少量杂质构成的,均属混合物。没有固定的几何外形,所以称为无定形碳,在工业上有着重要用途。回答下列问题:
(1)木炭与硫黄、火硝(硝酸钾)按一定比例混合即为黑火药。黑火药爆炸时生成硫化钾、氮气和二氧化碳。黑火药爆炸的化学方程式为____________。若有15g木炭参加反应,转移电子数为____________。
(2)工业上的炭黑是由烃类裂解而制得的高度分散性的黑色粉末状物质。
①已知几个反应的热化学方程式:
C(s)+O2 (g)CO2(g) ΔH1=393.5 kJmol1
2H2(g)+O2 (g)2H2O(1) ΔH2=571.6 kJmol1
CH4(g)+2O2(g)CO2(g)+ 2H2O(1) ΔH3=890.3 kJmol1
则由天然气生产炭黑的热化学方程式为____________。
②右图是温度对天然气生产炭黑转化率的影响,下列有关说法正确的是____________。
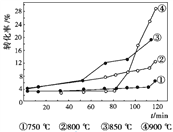
A. 甲烷裂解属于吸热反应
B. 增大体系压强,能提高甲烷的转化率
C. 在反应体系中加催化剂,反应速率增大
D. 升高温度,该反应的平衡常数减小
(3)活性炭可以用来净化气体和液体。
①用活性炭还原氮氧化物,可防止空气污染。向1 L密闭容器加入一定量的活性炭和NO,某温度下发生反应C(s)+ 2NO(g)![]() N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
N2(g)+CO2(g),测得不同时间内各物质的物质的量如下表:
物质的量/mol 时间/min | NO | N2 | CO2 |
0 | 0.200 | 0 | 0 |
10 | 0.116 | 0.042 | 0.042 |
20 | 0.080 | 0.060 | 0.060 |
30 | 0.080 | 0.060 | 0.060 |
此温度下,该反应的平衡常数K=____________ (保留两位小数)。10~20min内,NO的平均反应速率为____________;若30 min后升高温度,达到新平衡时,容器中c(NO)∶c(N2)∶c(CO2)=2∶1∶1,则该反应的ΔH____________0(填“>”、“<”或“=”)。
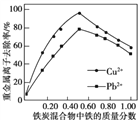
②活性炭和铁屑混合可用于处理水中污染物。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中span>Cu2+和Pb2+的去除率,结果如图所示。当混合物中铁的质量分数为0时,也能去除水中少量的Cu2+和Pb2+,其原因是____________;当混合物中铁的质量分数大于50%时,随着铁的质量分数的增加,Cu2+和Pb2+的去除率不升反降,其主要原因是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com