
科目: 来源: 题型:
【题目】乙二醇(沸点:197.3℃)是一种重要的基础化工原料。由煤基合成气(主要成分CO、H2)与氧气先制备得到草酸二甲酯(沸点:164.5℃),再加氢间接合成乙二醇,具有反应条件温和、环境污染小等优点。反应过程如下:
反应I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
反应II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反应III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
请回答下列问题:
(1)煤基合成气间接合成乙二醇的总热化学方程式是_____________________________,已知该反应在较低温条件下能自发进行。说明该反应的△H ______0(填“>”“<”或“=”)。
(2)CO、CH3ONO各0.4mol在恒温、容积恒定为2L的密闭容器中发生反应II,达到平衡时CO的体积分数与NO的体积分数相等,计算该反应的化学平衡常数K=_____________。若此时向容器中再通入0.4molNO,一段时间后,达到新平衡时NO的体积分数与原平衡时相比______(填“增大”“相等”“减小”或“不能确定”)。
(3)温度改变对反应II的催化剂活性有影响,评价催化剂的活性参数——空时收率和CO的选择性可表示如下:
空时收率=CH3OOCCOOCH3质量/反应时间×催化剂的体积
CO的选择性=合成[CH3OOCCOOCH3所消耗的CO的物质的量/反应掉的CO的物质的量]×100%
在不同温度下,某学习小组对四组其他条件都相同的反应物进行研究,经过相同时间th,测得空时收率、CO的选择性数据如下表所示。
反应温度(℃) | 空时收率(g·mL-1·h-1) | CO的选择性(%) |
130 | 0.70 | ①72.5 |
140 | 0.75 | ②71.0 |
150 | 0.71 | ③55.6 |
160 | 0.66 | ④63.3 |
下列说法正确的是________(填字母代号)。
A.温度升高,空时收率先增大后减小,说明△H2>0
B.温度升高,催化剂活性逐渐减弱,对CO的选择性逐渐降低
C.综合考虑空时收率和CO的选择性,工业生成CH3OOCCOOCH3时,选择140℃效果最好
D.130℃时,CO的选择性最高,说明CO生成CH3OOCCOOCH3的转化率最高
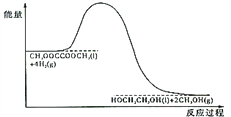
(4)120℃、常压时,CH3OOCCOOCH3+4H2![]() HOCH2CH2OH+2CH3OH反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
HOCH2CH2OH+2CH3OH反应过程中的能量变化如图所示。画出180℃、常压时,加入催化剂,该反应过程中的能量变化图。________
(5)研究证实,乙二醇、氧气可以在碱性溶液中形成燃料电池,负极的电极反应式是________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】I.反应Fe+H2S04=FeS04+H2↑的能量变化趋势,如图所示:

(1)该反应为______反应(填“吸热”或“放热”)。
(2)若将上述反应设计成原电池,铜为原电池某一极材料,则铜为______极(填“正”或“负”)。铜片上产生的现象为_____________,该极上发生的电极反应为____________,
II.在容积为2 L的密闭容器中进行如下反应:A(g)+2B(g)=3C(g)+nD(g),开始时 A为4mol, B为6 mol, 5min末时测得C的物质的量为3mol,用D表示的化学反应速率![]() (D)为 0.2 mol/(Lmin).
(D)为 0.2 mol/(Lmin).
计算:
(1)5 min末A的物质的量浓度为_________。
(2)前5 min 内用B表示的化学反应速率![]() (B))为__________。
(B))为__________。
(3)化学方程式中n的值为_________。
(4)此反应在四种不同情况下的反应速率分别为:

其中反应速率最快的是________(填编号)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在做“观察DNA和RNA在细胞中的分布”实验时,如果选用植物细胞,则对其颜色有一定要求,这一要求及原因分别是 ( )
A.选择深色叶肉细胞,因为其中有叶绿体
B.尽量选择浅色或无色的植物细胞,避免细胞本身的颜色对实验结果的分析产生影响
C.选择深色细胞,这样可以和实验结果形成强烈对比,便于观察
D.颜色无所谓,因为DNA和RNA与染色剂的结合具有特异性
查看答案和解析>>
科目: 来源: 题型:
【题目】铈是地壳中丰度最高的稀土元素,可用作催化剂、合金添加剂,也可用于医药、制革、玻璃、纺织等工业。氟碳铈矿的主要化学成分为CeFCO3,它是提取铈的重要矿物原料。氟碳铈矿的冶炼处理工艺已经发展到十数种,其中一种提取铈的工艺流程如下图所示。

已知:焙烧后烧渣中含+4价的铈及十3价的其他稀土氟化物和氧化物。
请回答下列问题:
(1)CeFCO3中Ce元素的化合价为______。
(2)“焙烧”前将矿石粉碎成细颗粒的目的是___________________________________________。
(3)“酸浸I”步骤中CeO2转化为Ce3+,且产生黄绿色气体,该过程的离子方程式为___________________。
(4)“酸浸1”步骤中CeF4转化为难溶物Ce(BF4)3,加入可溶性钾盐的目的是__________________。
(5)“操作I”后,向溶液中加入NaOH溶液,调节溶液pH可获得Ce(OH)3沉淀,利用pH试纸测定溶液pH值的实验操作是__________________________________。当溶液中离子浓度小于1×10-6mol/L时视为沉淀完全,常温下,加入NaOH调节溶液的pH应大于____[已知Ce(OH)3的Ksp=8.0×10-21,1g2=0.3]。
(6)写出“氧化”步骤的化学方程式:_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
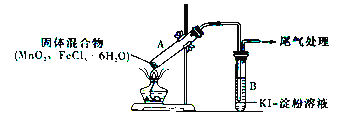
实验操作和现象如下表所示:
实验编号 | 操作 | 现象 |
实验1 | 按上图所示装置加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验2 | 把试管A中的混合物换为FeCl3·6H2O,试管B中溶液换为KSCN溶液,加热 | 试管A中部分固体溶解,产生白雾和黄色气体;试管B中KSCN溶液变红 |
请回答下列问题:
(1)实验1和实验2 产生白雾的原因是_____________________________。
(2)实验2说明黄色气体中含有_____________(填化学式)。
(3)为进一步确认黄色气体中是否含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在试管A、B间增加盛有某种试剂的洗气瓶C,结果试管B 中溶液仍变为蓝色。
方案2:将试管B中KI-淀粉溶液替换为NaBr溶液,结果试管B 中溶液呈橙红色,且未检出Fe2+。则方案1中洗气瓶C 中盛放的试剂是_________;方案2 中检验Fe2+的试剂的名称是______,选择NaBr溶液后试管B中发生的主要反应的离子方程式为______________________________________。
(4)实验1充分加热后,若将试管A中产物分离得到Fe2O3 和MnCl2,则试管A 中产生Cl2 的化学方程式为__________________________________________。其尾气处理的方法是_______________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________________。请你设计实验方案验证此猜想_______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某气态烃A能使溴的四氣化碳溶液褪色,其密度为相同条件下H2密度的14倍,完全燃烧产生等物质的里的CO2和H2O, A有如下转化关系,回答下列问题:
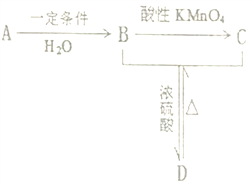
(1)A 的结构简式_______;B中含有的官能团名称______。
(2)A→B的反应类型为_______; C中含有的化学键类型_______。
(3)写出B+C→D的化学方程式_______;
(4)比A多一个碳的A的同系物与HCl气体反应得到的产物的同分异构体有_________种。
查看答案和解析>>
科目: 来源: 题型:
【题目】FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,则下列判断不正确的是( )
A.溶液中一定含Cu2+B.溶液中一定含Fe2+
C.剩余固体一定含CuD.加入KSCN溶液一定不变红色
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于核外电子排布的说法中不正确的是( )
A.第二电子层最多可容纳的电子数为8
B.次外层最多可容纳的电子数为18
C.最多可容纳2个电子的电子层一定是第一电子层
D.最多可容纳8个电子的电子层一定是第二电子层
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、M均为中学化学中的常见物质,A~D含有相同元素。其转化关系如下:
![]()
请回答:
(1)若A为淡黄色固体单质。
①A元素在周期表中的位置是_____。
②下列叙述正确的是_____(填字母序号)。
a.B属于大气污染物,是导致酸雨的重要原因之一
b.C可以与CaO反应生成CaSO3
c.D的浓溶液可以在加热条件下与金属Cu反应生成B
(2)若A为能使湿润红色石蕊试纸变蓝的气体。
①写出C→D的化学方程式:_____________________。
②A与C反应生成一种空气中含量最多的气体E,若该反应中转移6mol电子,则生成的E在标准状况下的体积为_____L。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,体积均为20 mL、浓度均为0.1mol/L的两种酸HX、HY分别与0.1mol/L的NaOH溶液反应,所加NaOH溶液体积与反应后溶液的pH的关系如图所示。下列叙述正确的是

A. 加入10 mL NaOH溶液时,a点c(X-)<b点c(Y-)
B. b点溶液中,c(Y-)+2c(OH-)=c(HY)+2c(H+)
C. HY中加NaOH溶液至pH=7 时,所得溶液中c(Y-)=c(Na+)=c(OH-)=c(H+)
D. 加入40 mL NaOH 溶液时,2c(Na+)=c(Y-)+c(HY)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com