
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值,下列说法正确的是(N﹣14 O﹣16 C﹣12 H﹣1)( )
A.常温常压下,46 g的NO2和N2O4混合气体含有的原子数为3NA
B.标准状况下,22.4 L CH2Cl2中含有的氯原子数目为2NA
C.16g CH4与18 g NH4+ 所含质子数相等
D.1molCu在足量硫蒸气中反应时转移2NA个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】用如图所示装置进行实验,正确的是
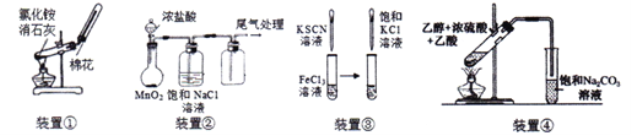
A. 用图①装置制取并收集氨气
B. 用图②装置制取和收集纯净的Cl2
C. 用图③装置可以看到试管内液体变为红色,滴加KCl溶液后颜色加深
D. 用图④装置制取乙酸乙酯
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ下图为H2和Cl2生成HCl过程中的能量变化:

请回答下列有关问题:
(1)H2+Cl2═2HCl是_______(填“吸热”或“放热”)反应,反应物的总能量_______(填“>”,“=”或“<”)生成物的总能量;
(2)当有1molHCl生成时,反应_________(填“吸收”或“放出”)的能量为________KJ。
Ⅱ 一个完整的氧化还原反应方程式可拆写成两个半反应式,一个为氧化反应式,一个为还原反应式。
(1)已知某一反应的半反应式分别为CH4+10OH-—8e-=CO32-+7H2O和O2+2H2O+4e-=4OH-请写出该反应的总反应式:________________________。
(2)下图为氢氧燃料电池的构造示意图:

X极为电池的______________(填“正”或“负”)极,X极的电极反应式为_____________________;若电池工作过程中有5.6LO2(标准状况下)参与反应,则转移电子的物质的量为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据元素周期表和元素周期律,判断下列叙述不正确的是 ()

A. 气态氢化物的稳定性:H2O>NH3
B. 氢元素与其他元素可形成共价化合物或离子化合物
C. 如图所示实验可证明元素的非金属性:Cl>C>Si
D. 人工合成的第118号元素在周期表中位于第七周期0族
查看答案和解析>>
科目: 来源: 题型:
【题目】下列反应中既是氧化还原反应,能量变化情况又符合下图的是

A. 铝片与稀盐酸的反应 B. NH4Cl和Ba(OH)2·8H 2 O的反应
C. 碳和水蒸气反应 D. 甲烷的燃烧反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关细胞内化合物的叙述,正确的是( )
A.水分子可缓和细胞的温度变化
B.无机盐在细胞内多以化合物存在
C.二糖和单糖均可进一步水解
D.磷脂是细胞内重要的贮能物质
查看答案和解析>>
科目: 来源: 题型:
【题目】我国科学家报道了如图所示的水溶液锂离子电池体系,下列叙述错误的是()
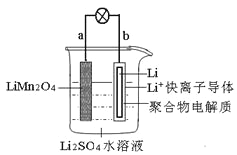
A. 放电时,a极锂的化合价发生变化
B. 电流的方向为a到b
C. a为电池的正极
D. 放电时,溶液中Li+从b向a迁移
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,部分物质的电离平衡常数如表所示:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | 1.7×10﹣5molL﹣1 | K1=4.4×10﹣7molL﹣1 | 3.0×10﹣8 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为 .
(2)常温下0.1molL﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是(填字母序号,下同).
A.c(H+) B. ![]() C.c(H+)c(OH﹣)
C.c(H+)c(OH﹣)
D. ![]() E.
E. ![]()
若该溶液升高温度,上述5种表达式的数据增大的是 .
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图: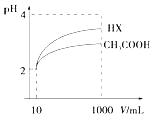
则HX的电离平衡常数(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是 .
(4)已知100℃时,水的离子积为1×10﹣12 , 该温度下测得某溶液pH=7,该溶液显(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b= .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com