
科目: 来源: 题型:
【题目】电子工业常用一定浓度的FeCl3溶液腐蚀敷有铜箔的绝缘板,制成印刷线路板。现将一块敷有铜箔的绝缘板没入500mL某浓度FeCl3溶液中,一段时间后,将该线路板取出,向所得溶液中加入一定量的铁粉,充分反应后有固体剩余;将固体滤出并从滤液中取出20.00mL,向其中滴入2.00mol/LAgNO3溶液60.00 mL时,溶液中的Cl-恰好完全沉淀。请回答下列有关问题(忽略反应前后溶液体积的变化):
(1)原FeCl3溶液的物质的量浓度为_____________________。
(2)假若剩余固体中有铁粉,则向溶液中加入的铁粉质量至少应当大于_______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关实验方法正确的是( )
A.用铜片和浓硝酸反应制NO
B.加热NH4Cl和Ca(OH)2固体混合物制取NH3
C.用浓硫酸干燥NH3
D.用排水法收集NO2
查看答案和解析>>
科目: 来源: 题型:
【题目】某校化学兴趣小组探究SO2与FeCl3溶液的反应,所用装罝如下图所示。请回答:

(1)装置A中分液漏斗内的物质是________________ 。
(2)实验时,旋开装置A中分液漏斗的旋塞,发现液体流出缓慢,最终停止,其可能的原因是___________________。
(3)实验过程中通入足量的SO2,请设计一个实验方案,验证SO2与FeCl3溶液反应的主要产物(H+无需检验)______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题干内容填空:
(1)某温度下,Kw=10﹣12 . 若保持温度不变,向少量水中加入g的NaOH固体,并加水稀释至1L,才能使溶液中水电离产生的H+、OH﹣的浓度乘积即:c(H+)水c(OH﹣)水=10﹣26 . 若保持温度不变,向水中通入的HCl气体恰好使溶液中c(H+)/c(OH﹣)=1010 , 则此时水电离的c(OH﹣)=molL﹣1 .
(2)一定温度下,现有a.盐酸,b.硫酸,c.醋酸 三种酸
①当三种酸体积相同,物质的量浓度相同时,使其恰好完全中和所需NaOH的物质的量由大到小的顺序是 . (用a、b、c表示)
②当三者c(H+)相同且体积也相同时,分别放入足量的锌,相同状况下产生气体的体积由大到小的顺序是 . (用a、b、c表示)
③当c(H+)相同、体积相同时,同时加入形状、密度、质量完全相同的锌,若产生相同体积的H2(相同状况),则开始时反应速率的大小关系为 . (用a、b、c表示)
(3)现有两瓶pH=2的盐酸和醋酸溶液,简述如何用最简单的方法区别盐酸和醋酸.(限选试剂:石蕊试液、酚酞试液、pH试纸、蒸馏水).采用的方法为 .
(4)执信中学A学生为了测定某烧碱样品的纯度,准确称量8.2g含有少量中性易溶杂质的样品,配成500mL待测溶液.用0.200 0molL﹣1的标准盐酸进行滴定,选择甲基橙作指示剂,试根据实验回答下列问题:
①滴定过程中,眼睛应注视;滴定终点时,溶液从色变为色, .
②观察酸式滴定管液面时,开始俯视,滴定终点平视,则滴定结果(填“偏高”、“偏低”或“无影响”);若将锥形瓶用待测液润洗,然后再加入10.00mL待测液,则滴定结果(填“偏高”、“偏低”或“无影响”).
③根据如表数据,通过标准酸滴定,计算待测烧碱溶液的物质的量浓度是 , 烧碱样品的纯度是 . (本小题计算结果保留4位有效数字)
滴定次数 | 待测溶液 | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的 | ||
第①次 | 10.00 | 0.40 | 20.50 |
第②次 | 10.00 | 4.10 | 24.00 |
第③次 | 10.00 | 2.20 | 23.80 |
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用CO生产燃料甲醇.一定条件下发生反应:CO(g)+2H2(g)CH3OH(g).图1表示反应中能量的变化;图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,CO和CH3OH(g)的浓度随时间变化.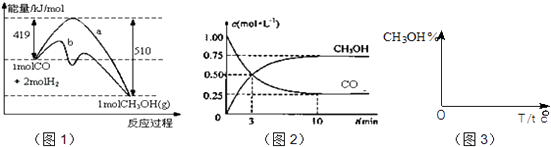
请回答下列问题:
(1)在“图1”中,曲线(填:a或b)表示使用了催化剂;该反应属于反应.
(2)下列说法正确的是 .
A.起始充入的CO为2mol
B.增加CO浓度,CO的转化率增大
C.容器中压强恒定时,反应已达平衡状态
D.保持温度和密闭容器容积不变,再充入1molCO和2molH2 , 再次达到平衡时,n(CH3OH)/n(CO)会减小
(3)从反应开始到建成平衡,v(H2)=;该温度下CO(g)+2H2(g)CH3OH(g)的化学平衡常数值为 . 若保持其它条件不变,将反应体系升温,则该反应化学平衡常数(填“增大”、“减小”或“不变”).
(4)请在“图3”中画出平衡时甲醇百分含量(纵坐标)随温度(横坐标)变化的曲线,要求画压强不同的2条曲线(在曲线上标出P1、P2 , 且P1<P2).
(5)有一类甲醇质子交换膜燃料电池,需将甲醇蒸气转化为氢气,两种反应原理是
A、CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=+49.0kJ/mol
B、CH3OH(g)+ ![]() O2(g)=CO2(g)+2H2O(g);△H=﹣192.9kJ/mol
O2(g)=CO2(g)+2H2O(g);△H=﹣192.9kJ/mol
又知H2O(l)=H2O(g)△H=+44kJ/mol,请写出32g的CH3OH(g)完全燃烧生成液态水的热化学方程式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.氢氧化钠可用食物调整碱性的添加剂
B.棉、麻完全燃烧可以生成CO2和H2O
C.脂肪在一定条件下都能发生水解反应
D.汽油、柴油、煤油的主要成分都是碳氢化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】草酸钴是制备钴的氧化物的重要原料。下图为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
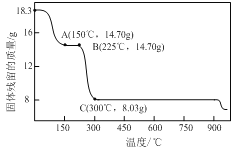
①通过计算确定C点剩余固体的化学成分为________(填化学式);试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_______________________________________________;
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】烃A是一种重要的化工原料.己知A在标准状况下的密度为1.16gL﹣1,B可发生银镜反应.它们之间的转化关系如图:

请回答:
(1)有机物A中含有的官能团名称是____;
(2)反应④的原子利用率达100%,该反应的化学方程式是___________________________;
(3)将金属钠与有机物D反应所得的产物溶于水得饱和溶液,滴加2滴酚酞试液,加热后水溶液显红色,其原因是__________________________;(用离子方程式表示)
(4)下列说法正确的是________;
A.有机物C在一定条件下合成乙酸乙酯也能实现原子利用率100%
B.反应②、③、⑤的类型各不相同
C.由于乙酸乙酯和水均为无色液体,故用分液漏斗无法分离乙酸乙酯和水的混合物
D.相同条件下乙酸乙酯在氢氧化钠溶液中水解较在稀硫酸中更完全.
查看答案和解析>>
科目: 来源: 题型:
【题目】在Na+浓度为1.0 molL-1的某澄清溶液中,还可能含有K+、Mg2+、Fe3+、Ba2+、CO32-、SO32-、SiO32-、Cl-、SO42-等离子,取该溶液100mL 进行下图连续实验(所加试剂均过量,气体全部逸出)。下列说法不正确的是

A. 原溶液中一定不存在Mg2+、Fe3+、Ba2+、SO42-
B. 在l00mL原溶液中加入足量BaCl2溶液,至少可生成沉淀20.5g
C. 为确定原溶液中是否含有Cl-,可取滤液C,加入AgNO3和稀HNO3溶液
D. 原溶液一定存在K+,c(K+)可能为1.5 molL-1
查看答案和解析>>
科目: 来源: 题型:
【题目】碲(Te)广泛用于彩色玻璃和陶瓷。工业上用精炼铜的阳极泥(含有质量分数为8%的TeO2、少量Ag、Au)为原料制备单质碲的一种工艺流程如下:(已知TeO2微溶于水,易溶于强酸和强碱)
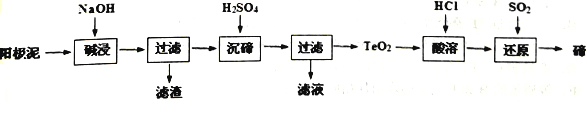
下列有关说法不正确的是
A. 将阳极泥研磨、反应适当加热都有利于提高“碱浸”的速率和效率
B. “沉碲”时为使碲元素沉淀充分,应加入过量的硫酸
C. “碱浸”时发生主要反应的离子方程式为TeO2+2OH-=TeO32-+H2O
D. 若提取过程碲元素的回收率为90%,则处理IKg这种阳极泥最少需通入标准状况下SO220.16L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com