
科目: 来源: 题型:
【题目】下列有关热化学方程式的叙述正确的是( )
A.反应物的总能量低于生成物的总能量时,该反应必须加热才能发生
B.2H2(g)+O2(g)=2H2O(l);△H=﹣571.6kJmol﹣1 , 则氢气燃烧热为285.8kJmol﹣1
C.含20.0g NaOH的稀溶液与稀盐酸完全中和,放出28.65kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)=CH3COONa(aq)+H2O(l)△H=﹣57.3kJmol﹣1
D.已知2SO2(g)+O2(g)2SO3(g);△H=﹣QkJmol﹣1(Q>0),则将16gSO2(g)和足量O2置于一密闭容器中,充分反应后放出0.25QkJ的热量
查看答案和解析>>
科目: 来源: 题型:
【题目】为测定某H2C2O4溶液的浓度,取该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定.
(1)滴定原理为:(用离子方程式表示).
(2)滴定时,KMnO4溶液应装在(填“酸式”或“碱式”)滴定管中,达到滴定终点时的现象为 .
(3)如图表示50mL滴定管中液面的位置,此时滴定管中液面的读数为mL.
(4)为了减小实验误差,该同学一共进行了三次实验,假设每次所取H2C2O4溶液体积均为VmL,三次实验结果记录如下:
实验次数 | 第一次 | 第二次 | 第三次 |
消耗KMnO4溶液体积/mL | 26.32 | 25.35 | 25.30 |
从上表可以看出,第一次实验中记录消耗KMnO4溶液的体积明显多于后两次,其原因可能是
A.实验结束时俯视刻度线读取滴定终点时KMnO4溶液的体积.
B.滴定前滴定管尖嘴有气泡,滴定结束无气泡.
C.第一次滴定盛装标准液的滴定管装液前用蒸馏水清洗过,未用标准液润洗,后两次均用标准液润洗.
D.第一次滴定用的锥形瓶用待装液润洗过,后两次未润洗.
E.滴加KMnO4溶液过快,未充分振荡,刚看到溶液变色,立刻停止滴定.
(5)根据所给数据,写出计算H2C2O4的物质的量浓度的表达式(不必化简):C=mol/L.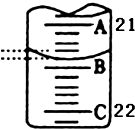
查看答案和解析>>
科目: 来源: 题型:
【题目】高锰酸钾可用于生活消毒,是中学化学常见的氧化剂。工业上,用软锰矿制高锰酸钾的流程如下:
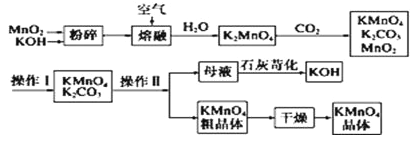
请回答下列问题:
(1)MnO2和KOH在熔融前粉碎的目的是_____________________________________________。
(2)写出二氧化锰和氢氧化钾熔融物中通入空气时发生的主要反应的化学方程式___________。
(3)通入CO2后,生成的KMnO4与MnO2的物质的量之比为___________。
(4)上述流程中可以循环使用的物质有___________、___________(填化学式)。
(5)已知:常温下,Ksp[Mn(OH)2]=2.4×10-13工业上,调节pH可以沉淀废水中Mn2+,当pH=10时,溶液中c(Mn2+)=___________mol/L。
(6)操作Ⅰ的名称是___________,操作Ⅱ根据下表KMnO4和K2CO3两物质在溶解性上的差异,采用___________、___________(填操作步骤)得到KMnO4粗晶体。
| 10 | 20 | 30 | 40 | 60 |
K2CO3 | 109.0 | 111.0 | 114.0 | 117.0 | 126.0 |
KMnO4 | 4.3 | 6.3 | 9.0 | 12.6 | 22.1 |
查看答案和解析>>
科目: 来源: 题型:
【题目】碳和氮是地球上含量丰富的两种元素。其氧化物的化学热力学、动力学研究有助于人类充分利用化石燃料,消除氧化物对环境的负面影响。
(1)下图是25℃,101kPa时,1molNO2气体和1molCO反应生成CO2和NO过程中能量变化示意图。写出该反应的热化学方程式____________________________________。
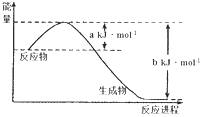
(2)在不同温度下,向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s)![]() N2(g)+CO2(g),达到平衡时的数据如下:
N2(g)+CO2(g),达到平衡时的数据如下:
温度 | n(C)/mol | n(CO2)/mol |
T1 | 0.3 | |
T2 | 0.6 |
请回答下列问题:
①T1℃时,该反应的平衡常数K=___________。
②T2℃时,下列能判断该反应达到平衡状态的是___________(填序号)。
A.v(CO2)正=2v(NO)逆 B.混合气体的平均相对分子质量不再变化
C.混合气体的密度不再变化 D.N2、CO2的物质的量之比不再变化
③T2℃时,若达平衡后再充入0.4molNO和0.3molCO2,平衡向___________(填“正向”“逆向“或“不”)移动。
④若△H<O,则T1___________T2(填“>”或“<”)。
(3)电解法处理含氮氧化物废气,可回收硝酸。实验室模拟电解法吸收NOx的装置如右图所示:

①若用NO2气体进行模拟电解法吸收实验,写出NO2发生反应的电极反应式________________。
②若有标况下2.24LNO被吸收,通过阳离子交换膜的H+为___________mol。
查看答案和解析>>
科目: 来源: 题型:
【题目】现有25℃时0.1molL﹣1的氨水,请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,一水合氨的电离平衡移动(填“向左”、“向右”或“不”);此时溶液中C(OH﹣)/C(NH3H2O)(填“增大”、“减小”或“不变”).
(2)若向氨水中加入稀硫酸至溶液的pH=7,此时C(NH4+)=a molL﹣1 , 则C(SO42﹣)= .
(3)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:;
所得溶液的pH7(填“>”、“<”或“=”),用离子方程式表示其原因 , 所得溶液中各离子的物质的量浓度由大到小的顺是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是一种可再生能源,具有广泛的开发和应用前景.工业上一般采用下列两种反应合成甲醇.
反应Ⅰ:CO(g)+2H2(g)CH3OH(g)△H1
反应Ⅱ:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K):
温度 | 250℃ | 300℃ | 350℃ |
K | 2.0 | 0.27 | 0.012 |
(1)在一定条件下将2mol CO和6mol H2充入2L的密闭容器中发生反应Ⅰ,5min后测得c(CO)=0.4mol/L,计算可得此段时间的反应速率(用H2表示)为mol/(Lmin).
(2)由表中数据判断△H10 (填“>”、“<”或“=”);
反应CO2(g)+H2(g)CO(g)+H2O(g)△H3= (用△H1和△H2表示).
(3)若容器容积不变,则下列措施可提高反应Ⅰ中CO转化率的是 (填字母序号).
a.充入CO,使体系总压强增大 b.将CH3OH(g)从体系中分离
c.充入He,使体系总压强增大 d.使用高效催化剂
(4)写出反应Ⅱ的化学平衡常数表达式:KⅡ=;保持恒温恒容,将反应Ⅱ的平衡体系中各物质浓度均增大为原来的2倍,则化学平衡移动(填“正向”、“逆向”或“不”),平衡常数KⅡ(填“变大”、“变小”或“不变”).
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关糖类的说法,错误的是( )
A.糖类由碳、氢、氧三种元素组成
B.糖类是人类食物的重要成分之一
C.在人类食物所提供的总能量中大约有75%来自糖类
D.淀粉在人体内经酶的催化作用,与水发生一系列反应,最终变为蔗糖
查看答案和解析>>
科目: 来源: 题型:
【题目】在合理的膳食中,糖类、脂肪和蛋白质三者供热能由多到少的顺序是( )
A.糖类、蛋白质、脂肪
B.脂肪、糖类、蛋白质
C.蛋白质、脂肪、糖类
D.糖类、脂肪、蛋白质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com