
科目: 来源: 题型:
【题目】(1)紫薯营养丰富,具有特殊的保健功能。下表是100 g紫薯粉的营养成分含量表:
营养成分 | 含量(每100 g) | 营养成分 | 含量(每100 g) |
水分 | 9.9 g | 钙元素 | 23.00 mg |
脂肪 | 0.2 g | 铁元素 | 1.10 mg |
蛋白质 | 4.8 g | 硒元素 | 0.02 mg |
淀粉 | 82.5 g | 花青素 | 0.10 g |
纤维素 | 2.7 g | 其他 | …… |
①以上营养成分中,______是人体中含有的微量元素。
②紫薯粉中的脂肪在人体内会水解成高级脂肪酸和______。
③蛋白质在人体内水解的最终产物是氨基酸,其结构可表示为R—CH(NH2)—X,则“—X”的名称为___。
④在酶的作用下,淀粉水解为葡萄糖,葡萄糖再转化为乙醇和二氧化碳。写出葡萄糖转化为乙醇的化学方程式______。
(2)合理饮食、正确使用药物对人体健康至关重要。
①“中国居民平衡膳食宝塔”如图所示,位于最上层且每天不超过25g的能量物质是______。
②某品牌饼干的配料标签如图所示,其中苯甲酸钠的作用是______。

③三硅酸镁(Mg2Si3O8·nH2O)具有治疗胃酸过多的作用,写出其与胃酸反应生成SiO2·H2O等物质的化学方程式______。
(3)材料的生产与使用是人类文明和生活进步的一个重要标志。
①我国C919大型客机的机身蒙皮使用的是第三代铝锂合金材料,选用铝锂合金的优点是______(任答一点)。
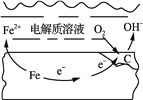
②铁路建设中如何防止铁轨的腐蚀是工程技术人员攻克的难题之一。钢铁在潮湿的空气中易发生吸氧腐蚀如图所示,则正极的电极反应式为______。
③玻璃中加入适量的溴化银(AgBr)和氧化铜的微小晶粒,经过适当的热处理,可以制成变色玻璃,请写出强光照射变色玻璃时发生反应的化学方程式______。
查看答案和解析>>
科目: 来源: 题型:
【题目】现在人们时尚养各种宠物,宠物猪很是令人青睐。宠物猪的活细胞中含量最多的化合物与含量最多的有机化合物共有的化学元素是 ( )
A.C、H、O B.C、H、O、N C.H、O D.N、P、S
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法错误的是( )
A.C2H6和C4H10一定是同系物
B.C2H4和C4H8一定都能使溴水褪色
C.C3H6不只表示一种物质
D.单烯烃各同系物中碳的质量分数相同
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于食品添加剂的说法,不正确的是( )
A.醋可同时用作防腐剂和调味剂
B.食品添加剂必须用天然物质制造
C.柠檬黄常用作着色剂,改善食品色泽
D.食品添加剂在合理限量范围内使用是可以的
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F六种元素位于短周期,原子序数依次增大,C基态原子核外有三个未成对电子,B与D形成的化合物BD与C的单质C2电子总数相等,CA3分子结构为三角锥形,D与E可形成E2D与E2D2两种离子化合物,D与F是同族元素.
根据以上信息,回答下列有关问题:
(1)写出基态时D的电子排布图 .
(2)写出化合物E2F2的电子式 , 化合物ABC的结构式 .
(3)根据题目要求完成以下填空:
BF32﹣中心原子杂化方式;D3中心原子杂化方式;
FD42﹣微粒中的键角;FD3分子的立体构型 .
(4)根据等电子原理,指出与BD2互为等电子体且含有C原子的微粒有、(要求写一种分子和一种离子).
查看答案和解析>>
科目: 来源: 题型:
【题目】在容积为1.00L的容器中,通入一定量的N2O4 , 发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深.回答下列问题:
(1)反应的△H0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示.在0~60s时段,反应速率v(N2O4)为 molL﹣1s﹣1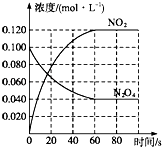
(2)100℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0molL﹣1s﹣1的平均速率降低,经10s又达到平衡.T100℃(填“大于”或“小于”),判断理由是 .
(3)温度T时反应达平衡后,将反应容器的容积减少一半.平衡向(填“正反应”或“逆反应”)方向移动,判断理由是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】根据题意回答下列问题
(I)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水.当把0.4mol液态肼和0.8mol H2O2混合反应,生成氮气和水蒸气,放出256.7kJ的热量(相当于25℃、101kPa下测得的热量).
(1)反应的热化学方程式为 .
(2)又已知H2O(l)=H2O(g)△H=+44kJ/mol.则16g液态肼与液态双氧水反应生成液态水时放出的热量是kJ.
(3)此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是 .
(4)(II)某实验小组测定中和热做了三次实验,所用NaOH溶液的浓度为0.55molL﹣1 , 盐酸的浓度为0.5molL﹣1 , 每次取NaOH溶液和盐酸溶液各50mL,并记录如表原始数据.
实验序号 | 起始温度t1/℃ | 终止温度(t2)/℃ | 温差(t2﹣t1)/℃ | ||
盐酸 | NaOH溶液 | 平均值 | |||
① | 25.1 | 24.9 | 25.0 | 28.3 | 3.3 |
② | 25.1 | 25.1 | 25.1 | 28.4 | 3.3 |
③ | 25.1 | 25.1 | 25.1 | 28.5 | 3.4 |
已知盐酸、NaOH溶液密度近似为1.00gcm﹣3 , 中和后混合液的比热容c═4.18×10﹣3 kJg﹣1℃﹣1 , 则该反应的中和热为△H= .
(5)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热会(填“偏大”、“偏小”或“不变”),其原因是 .
(6)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热(填“偏大”、“偏小”或“不变”).
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题:
(1)有下列六种物质:①碳60(C60)晶体②硼晶体③Na2O晶体④CaF2晶体⑤P4O10晶体⑥碳化硅晶体.其中属于离子晶体的是 , 属于分子晶体的是 , 属于原子晶体的是 .
(2)有下列分子:HCN、P4、SO2、PCl3、BF3 , 其中属于非极性分子的是 .
(3)有下列离子:SO32﹣、SO42﹣、CO32﹣ , 其中空间构型为正四面体形的是 , 中心原子的杂化轨道类型属于sp2杂化的是 .
(4)CaO晶胞如图所示,CaO晶体中Ca2+的配位数为;与每一个钙离子距离最近并且距离相等的钙离子有个.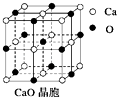
查看答案和解析>>
科目: 来源: 题型:
【题目】没有水,人体内大部分化学反应就无法进行,这说明 ( )
A.水在生物体内可以流动
B.生物体内的生化反应必须在水中进行
C.水是细胞内含量最多的化合物
D.水具有缓和温度变化的作用
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com