
科目: 来源: 题型:
【题目】具有显著抗癌活性的10﹣羟基喜树碱的结构如图所示.下列关于10﹣羟基喜树碱的说法正确的是( ) 
A.分子式为C20H16N2O5
B.不能与FeCl3溶液发生显色反应
C.不能发生酯化反应
D.一定条件下,1mol该物质最多可与1mol NaOH反应
查看答案和解析>>
科目: 来源: 题型:
【题目】NA为阿伏加德罗常数,下列说法正确的是
A. 标准状况下,22.4L NO和11.2LO2混合后气体的分子总数为NA
B. 1L1mol·L-1的Na2CO3溶液中含有的阴离子数目大于NA
C. 100mL 12mol·L-1浓盐酸与足量的MnO2共热,转移的电子数为0.6NA
D. 所含共价键数均为0.4NA的白磷(P4)和甲烷的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】碱性锌锰电池是日常生活中消耗量最大的电池,其构造如图所示。
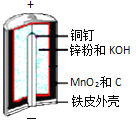
放电时总反应为:Zn + 2H2O + 2MnO2![]() Zn(OH)2 + 2MnOOH
Zn(OH)2 + 2MnOOH
从废旧碱性锌锰电池中回收Zn和MnO2的工艺如下:
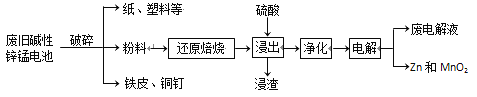
回答下列问题:
(1)MnOOH中,Mn元素的化合价为________。
(2)“还原焙烧”过程中,高价金属化合物被还原为低价氧化物或金属单质(其中MnOOH、MnO2被还原成MnO),主要原因是“粉料”中含有________。
(3)“净化”是为了除去浸出液中的Fe2+,方法是:加入________(填化学式)溶液将Fe2+氧化为Fe3+,再调节pH使Fe3+完全沉淀。(离子浓度小于1×10-5mol·L-1即为沉淀完全)已知浸出液中Mn2+、Zn2+的浓度约为0.1 mol·L-1,根据下列数据计算调节pH的合
理范围是________至________。
化合物 | Mn(OH)2 | Zn(OH)2 | Fe(OH)3 |
KSP近似值 | 10-13 | 10-17 | 10-38 |
(4)“电解”时,阳极的电极反应式为_____。本工艺中应循环利用的物质是_____(填化学式)。
(5)若将“粉料”直接与盐酸共热反应后过滤,滤液的主要成分是ZnCl2和MnCl2。“粉料”中的MnOOH与盐酸反应的化学方程式为________。
(6)某碱性锌锰电池维持电流强度0.5A(相当于每秒通过5×10-6 mol电子),连续工作80分钟即接近失效。如果制造一节电池所需的锌粉为6 g,则电池失效时仍有________%的金属锌未参加反应。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,Zn、Cu与稀硫酸形成的原电池装置中,负极材料为___,负极反应式为____________________;正极材料为_____,正极反应式为____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语正确的是( )
A.氟化氢的电子式: ![]()
B.氯原子的结构示意图: 
C.氯化钠的电离方程式:NaCl=Na++Cl﹣
D.乙醇的结构式:C2H6O
查看答案和解析>>
科目: 来源: 题型:
【题目】二氯亚砜(SOCl2)是一种无色易挥发液体,遇水剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解。
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成二氯亚砜,原子利用率达100%,则三者的物质的量比为________。写出SOCl2吸收水蒸气的化学方程式:____________。
(2)甲同学设计下图装置用ZnCl2·xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略):

①装置的连接顺序为A→B→______→______→______→______。
②搅拌的作用是______,冷凝管的作用是______。
③实验结束后,为检测ZnCl2·xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg。若![]() _____(保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
_____(保留一位小数),即可证明ZnCl2·xH2O晶体已完全脱水。
④乙同学认为直接将ZnCl2·xH2O晶体置于坩埚中加热即可得到无水ZnCl2,但老师说此方法不可。请用化学方程式解释原因:____________。
(3)丙同学认为SOCl2还可用作由FeCl3·6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应。请你设计并简述实验方案判断丁同学的观点:_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、X是中学化学常见化合物或单质,均由短周期元素组成,转化关系如图。请据图回答下列问题:

(1)若A、B、C中均含同一种常见金属元素R,R在C中以阴离子形式存在,B为白色胶状沉淀。
①R在元素周期表中的位置为______________。
②若A的溶液中混有Fe3+,当向该混合液中加入氨水,生成R(OH)n及Fe(OH)3共沉淀时,溶液中c(Fe3+)/ c(Rn+)=____。[已知:Fe(OH)3的 Ksp=4.00×10-38,沉淀B的Ksp=1.32×10-33 ]
(2)若A、B、C的焰色反应均为黄色,水溶液均呈碱性。
①A中含有的化学键是________________________。
②将672 mL(标准状况下)X通入100 mL 0.4mol·L- 1 A的溶液后,溶液中离子浓度由大到小的顺序为_______________________。
③自然界中存在B、C和H2O按一定比例形成的固体。取一定量该固体制成100mL溶液,测得溶液中金属阳离子的浓度为0.5mol·L-1。若取相同质量的固体加热至恒重,剩余固体的质量为_______。
(3)若A、B、C中均含同一种常见非金属元素,其中A为黑色固体单质。已知298K下,1mol A、1 mol B完全燃烧生成稳定氧化物放出的热量分别为393.5 kJ,283 kJ。写出该温度下A与C反应生成B的热化学方程式:______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列溶液蒸干后,能析出溶质固体的是( )
①FeCl3 ②Fe2(SO4)3 ③Ca(HCO3)2 ④Na2CO3
A.仅①④
B.仅②④
C.仅①②
D.全部
查看答案和解析>>
科目: 来源: 题型:
【题目】2011年7月26日,我国自主研制的深海载人潜水器“蛟龙号”成功下潜至5 057米的深海,在这里发现了许多奇怪的生物。在这些生物体内,最基本的化学元素和含量最多的化学元素分别是
A. C和O B. O和C C. C和N D. O和H
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com