
科目: 来源: 题型:
【题目】已知草酸镍晶体(NiC2O42H2O)难溶于水,工业上从废镍催化剂(主要成分是Ni,含有一定量的Al2O3、Fe、SiO2、CaO等)制备草酸镍晶体的流程如图所示:
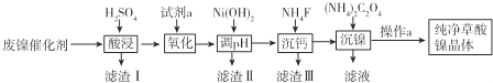
已知:①相关金属离子生成氢氧化物沉淀的pH如表:
金属离子 | Fe3+ | Fe2+ | Al3+ | Ni2+ |
开始沉淀的pH | 1.1 | 5.8 | 3.0 | 6.8 |
完全沉淀的pH | 3.2 | 8.8 | 5.0 | 9.5 |
②Ksp(CaF2)=1.46×10-10
③当某物质浓度小于1.0×10-5mol·L-1时,视为完全沉淀.
请回答下列问题:
(1)请写出一种能提高“酸浸”速率的措施:______________________________________。
(2)试剂a是一种绿色氧化剂,写出氧化时反应的离子方程式:__________________________________。
(3)调节pH的范围为________,试用化学反应原理的相关知识解释滤渣Ⅱ的生成:_____________。
(4)写出沉镍时反应的离子方程式:________________________________________________。证明Ni2+已经沉淀完全的实验步骤及现象是_____________________________________。当Ca2+沉淀完全时,溶液中c(F-)>________mol·L-1。
(5)操作a的内容是_____________________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钛性能优越,被誉为继Fe、Al后应用广泛的“第三金属”。
(1)Ti基态原子的价层电子排布图为_______________________。
(2)钛能与B、C、N、O等非金属元素形成稳定的化合物。电负性:C________(填“>”或“<”,下同)B;第一电离能:N________O,原因是____________________________________。
(3)月球岩石——玄武岩的主要成分为钛酸亚铁(FeTiO3)。FeTiO3与80%的硫酸反应可生成TiOSO4。SO42-的空间构型为_________形,其中硫原子采用_________杂化,写出SO42-的一种等电子体的化学式:____________________________。
(4)Ti的氧化物和CaO相互作用能形成钛酸盐CaTiO3,CaTiO3的晶体结构如图1所示(Ti4+位于立方体的顶点)。该晶体中,Ti4+和周围________个O2-相紧邻。

(5)铁晶胞的结构如图2所示,如果晶胞边长为a,铁原子半径为r,则该晶体中铁原子的空间利用率为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】化学与生活密切相关,下列们关说法正确的是
A. 石墨具有良好的润滑性,故可用做电池的电极材料。
B. 碳酸钠溶液呈碱性,故可用带玻璃塞的试剂瓶盛放
C. 液氮的沸点较低,故可为超导材料提供低温环境
D. 单晶硅的硬度较高,故可用于制备电子芯片
查看答案和解析>>
科目: 来源: 题型:
【题目】能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义。
(1)二氧化碳能引起温室效应,而对二氧化碳的捕集、利用是当今世界能源领域的一个重要研究方向。工业上用CO2和H2在一定条件下反应可合成二甲醚,已知:CO2(g)+3H2(g)═CH3OH(g)+H2O(g);△H1=-53.7kJ/mol
CH3OCH3(g)+H2O(g)═2CH3OH(g);△H2=+23.4kJ/mol
则2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g);△H3=________kJ/mol
CH3OCH3(g)+3H2O(g);△H3=________kJ/mol
(2)在一定条件下CO2和H2充入一定固定容积的密闭容器中,在两种不同温度下发生反应:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图1所示。
CH3OCH3(g)+3H2O(g),测得CH3OCH3(g)的物质的量随时间的变化如图1所示。


①曲线I、Ⅱ对应的平衡常数大小关系为KI________KⅡ(填“>”或“=”或“<”)。
②一定温度下,若此反应在恒压容器中进行,不能判断该反应达到化学平衡状态依据的是______。
a.混合气体的密度 b.CH3OCH3(g)和H2O(g)体积比不变
c.c(H2)=2c(H2O) d.4个C=O断裂的同时有6个H-O断裂
③一定条件下,上述合成二甲醚的反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是________(填代号)。
A.CO2的转化率增大 B.逆反应速率先增大后减小
C.容器中的![]() 值变大 D.平衡常数增大
值变大 D.平衡常数增大
(3)合成气CO和H2在一定条件下能发生如下反应:CO(g)+2H2(g)![]() CH3OH(g);△H。
CH3OH(g);△H。
①在某压强下,合成甲醇的反应在不同温度、不同投料比时,CO的转化率如图2所示。500K温度下,将2molCO和4molH2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OH)=________。
②△H________0(填“>”或“=”或“<”)。
③上述合成甲醇的过程中提高CO的转化率可采取的措施有________、________(回答2点)。
查看答案和解析>>
科目: 来源: 题型:
【题目】比较小麦和家兔体内的各种化学元素( )
A. 种类和含量都相差很大
B. 种类和含量都相差不大
C. 种类相差很大,其中相同元素的含量都大体相同
D. 种类大体相同,其中相同元素的含量不同
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学实验室产生的废液中含有Fe3+、Cu2+、Ba2+、Cl﹣四种离子,现设计下列方案对废液进行处理,以回收金属并制备氯化钡、氯化铁晶体. 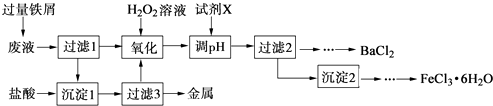
(1)沉淀1中含有的金属单质是 .
(2)氧化时加入H2O2溶液发生反应的离子方程式为 .
(3)下列物质中,可以作为试剂X的是 (填字母).
A.BaCl2
B.BaCO3
C.NaOH
D.Ba(OH)2
(4)检验沉淀2洗涤是否完全的方法是 .
(5)制备氯化铁晶体过程中需保持盐酸过量,其目的是 .
(6)由过滤2得到的滤液制备BaCl2的实验操作依次为、冷却结晶、、洗涤、干燥.
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇不仅作为F1赛车的燃料添加剂,也广泛应用于甲醇燃料电池。某燃料电池装置如图所示,下列说法错误的是( )

A. 乙池负极反应为:CH3OH-6e-+3CO32-=4CO2↑+2H2O
B. 乙池中电池工作时,CO32-不断移向负极
C. 理论上32g甲醇被消耗时,C极上放出气体体积(标准状况下)为67.2L
D. 甲池中Cu电极发生的反应为2Cl--2e-=Cl2↑
查看答案和解析>>
科目: 来源: 题型:
【题目】甲酸香叶酯是一种食品香料.可以由香叶醇与甲酸发生酯化反应制得.下列说法中正确的是( ) 
A.香叶醇的分子式为C11H18O
B.香叶醇在浓硫酸、加热条件下可发生消去反应
C.1 mol甲酸香叶酯可以与2 molH2发生加成反应
D.甲酸香叶酯分子中所有碳原子均可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com