
科目: 来源: 题型:
【题目】“抗击新冠肺炎疫情,人人都有群防责任”,下列做法符合科学道理的是()
A.出门不佩戴口罩B.家庭消毒时,消毒液越浓越好
C.保持室内清洁卫生和通风D.大量喝酒可以预防“新型冠状病毒”
查看答案和解析>>
科目: 来源: 题型:
【题目】光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性碳催化下合成.
(1)实验室中常用来制备氯气的化学方程式为;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(△H)分别为﹣890.3kJmol﹣1、﹣285.8 kJmol﹣1和﹣283.0 kJmol﹣1 , 则生成1 m3(标准状况)CO所需热量为;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为;
(4)COCl2的分解反应为COCl2(g)═Cl2(g)+CO(g)△H=+108 kJmol﹣1 . 反应体系平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出): 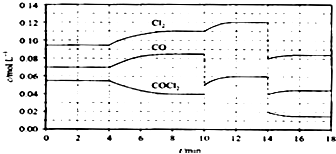
①计算反应在第8min时的平衡常数K=;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)(填“<”、“>”或“=”);
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)=molL﹣1
④比较产物CO在2﹣3min、5﹣6min和12﹣13min时平均反应速率[平均反应速率分别以v(2﹣3)、v(5﹣6)、v(12﹣13)表示]的大小;
⑤比较反应物COCl2在5﹣6min和15﹣16min时平均反应速率的大小:v(5﹣6) v(15﹣16)(填“<”、“>”或“=”),原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质互为同系物的是( )
A. 金刚石和石墨 B. CH3-CH2-CH2-CH3和CH3-CH(CH3)-CH3
C. CH4 和 C2H6 D. 16O和18O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.酸雨是指pH小于7的降水
B.水泥、玻璃、水晶饰物和珍珠都是硅酸盐制品
C.城市空气质量报告中包括PM2.5、SO2、NO2、CO2等污染物
D.钢是用量最大、用途最广的合金,青铜是我国历史上最早使用的合金
查看答案和解析>>
科目: 来源: 题型:
【题目】已知34Se、35Br位于同一周期,根据元素在周期表中的位置,下列说法正确的是
A. 还原性:Cl->Br- B. 酸性:H2SeO4>HBrO4>HClO4
C. 原子半径:Cl>Br>Se D. 气态氢化物的稳定性:H2S>H2Se
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:
![]()
冠心平F是降血脂、降胆固醇的药物,它的一条合成路线如下:
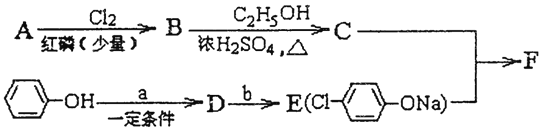
(1)A为一元羧酸,8.8gA与足量NaHCO3溶液反应生成2.24LCO2(标准状况),A的分子式为_________。
(2)写出符合A分子式的所有甲酸酯的结构简式:____________。
(3)B是氯代羧酸,其核磁共振氢谱有两个峰,写出B→C的反应方程式:_______。
(4)C+E→F的反应类型为___________。
(5)写出A和F的结构简式:A______;F_______
(6)D的苯环上有两种氢,它所含官能团的名称为________;写出a、b所代表的试剂:a. _______b. _______。
查看答案和解析>>
科目: 来源: 题型:
【题目】Cu与Zn用导线连接后浸入稀硫酸组成原电池装置。下列说法正确的是
A. 锌为负极,铜为正极
B. 铜片溶解,锌片上产生气体
C. 电子由铜极流出经导线流向锌极
D. 溶液中SO42-定向移向铜极
查看答案和解析>>
科目: 来源: 题型:
【题目】除去下列物质中的杂质,所用试剂和方法正确的是( )
物质 | 杂质 | 除杂质所用试剂和方法 | |
A | FeCl3 | FeCl2 | 加入足量的Fe粉,过滤 |
B | CO2 | HCl | 通入饱和Na2CO3溶液,洗气 |
C | SO2 | H2O | 通入浓硫酸,洗气 |
D | Mg | Cu | 加入浓硫酸,过滤 |
A.AB.BC.CD.D
查看答案和解析>>
科目: 来源: 题型:
【题目】研究硫元素及其化合物的性质具有重要意义.
(1)①硫离子的结构示意图为 . ②加热时,硫元素的最高价氧化物对应水化物的浓溶液与木炭反应的化学方程式为 .
(2)25℃,在0.10molL﹣1H2S溶液中,通入HCl气体或加入NaOH固体以调节溶液pH,溶液pH与c(S2﹣)关系如图(忽略溶液体积的变化、H2S的挥发). 
①pH=13时,溶液中的c(H2S)+c(HS﹣)=molL﹣1 .
②某溶液含0.020molL﹣1Mn2+、0.10molL﹣1H2S,当溶液PH=时,Mn2+开始沉淀.[已知:Ksp(MnS)=2.8×10﹣13]
(3)25℃,两种酸的电离平衡常数如表.
Ka1 | Ka2 | |
H2SO3 | 1.3×10﹣2 | 6.3×10﹣8 |
H2CO3 | 4.2×10﹣7 | 5.6×10﹣11 |
①HSO3﹣的电离平衡常数表达式K= .
②0.10molL﹣1Na2SO3溶液中离子浓度由大到小的顺序为 .
③H2SO3溶液和NaHCO3溶液反应的主要离子方程式为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com