
科目: 来源: 题型:
【题目】不符合原子核外电子排布基本规律的是
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列实验方案的设计与评价合理的是 (_____)
A | B | C | D |
|
|
|
Ⅰ为Al电极,其他均为Cu电极 |
| 验证氧化性:Cl2>Br2>I2 | 验证温度对平衡移动的影响 | 电子流动方向:电极Ⅳ→A→电极Ⅰ |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】维生素C又名抗坏血酸,结构简式为 .维生素C在碱性溶液中易被氧化,能被I2定量氧化
.维生素C在碱性溶液中易被氧化,能被I2定量氧化 测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
测定橙子中维生素C的含量的实验步骤如下(所用蒸馏水均已煮沸冷却):
步骤一:将1.3 g I2溶于少量KI浓溶液,转入1000 mL容量瓶中,加入蒸馏水定容后置于棕色瓶避光保存,备用。
步骤二:称取100 g去皮、去核的新鲜橙子和40 mL草酸溶液混合榨汁,后将果汁全部移入锥形瓶,加入适量的活性炭,抽滤,将所得果汁稀释至100 mL密封保存。
步骤三:准确移取10.00 mL果汁,加入20 mL l%草酸溶液和1mL l%淀粉溶液,用标准碘溶液进行滴定至终点,记录消耗的标准碘溶液的体积。
步骤四:重复步骤三2~3次。
步骤五:数据处理,计算100g橙子中维生素C的含量。
(1)步骤一中配制标准碘溶液时,将I2加入到KI浓溶液的目的是____________,所需要的玻璃仪器有烧杯、1000 mL容量瓶、_____;
(2)步骤二中加入活性炭的作用是____;抽滤使用的主要仪器是____;
(3)在步骤二和步骤三中均加入草酸溶液的目的是___________;
(4)步骤二和步骤三通常需控制在2分钟内完成,若超时会导致测定结果 ________填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氮氧化物具有不同程度的毒性,会破坏人体的中枢神经,长期吸入会引起脑性麻痹,手脚萎缩等,大量吸入时会引发中枢神经麻痹,记忆丧失,四肢瘫痪,甚至死亡等后果。构成电池方法既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,发生反应6NO2+8NH3= 7N2+12H2O,装置如图所示。下列关于该电池的说法正确的是 ( )
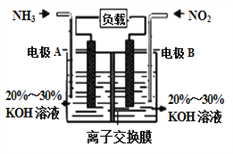
A. 电子从右侧电极经过负载后流向左侧电极
B. 为使电池持续放电,离子交换膜需选用阴离子交换膜
C. 电极A极反应式为2NH3-6e-=N2+6H+
D. 当有4.48LNO2被处理时,转移电子物质的量为0.8mol
查看答案和解析>>
科目: 来源: 题型:
【题目】固体碘化铵置于密闭容器中,加热至一定温度后恒温;容器中发生反应:①NH4I(s)![]() NH3(g)+HI(g)②2HI(g)
NH3(g)+HI(g)②2HI(g)![]() H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,反应①的平衡常数为20,则下列结论正确的是 ( )
H2(g)+I2(g),测得平衡时c(H2)=0.5mol/L,反应①的平衡常数为20,则下列结论正确的是 ( )
A. 平衡时HI分解率为20%
B. 当固体碘化铵物质的量增大一倍,则在相同条件下,容器内压强变大
C. 固体碘化铵一定完全分解
D. 平衡时C(HI)=5mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】镍、铂、镧等过渡金属单质及化合物在医疗领域有着广泛的应用。
(1)基态原子镍的价电子排布式为_______。
(2)抗癌药奥沙利铂(又名乙二酸铂)的结构简式如图所示。

①分子中氮原子轨道的杂化类型是_________,C、N、O三种元素的第一电离能由大到小的顺序为_____。
②1 mol乙二酸分子中含有σ键的数目为________________。
(3)碳酸镧[La2(CO3)3]可用于治疗高磷血症。写出与CO32-互为等电子体的一种分子的化学式: _______。
(4)镧镰合金可用于储氢,储氢之后所得晶体的化学式为LaNi5(H2)3,其晶体的最小重复结构单元如图所示(◎、O、●代表储氢之后晶体中的三种微粒)。图中●代表的微粒是_______。

查看答案和解析>>
科目: 来源: 题型:
【题目】采用新技术减少氮氧化物、SO2等物质的排放,可促进社会主义生态文明建设。
(1)采用“联合脱硫脱氮技术” 处理烟气(含CO2、SO2、NO)可获得含CaCO3、CaSO4、Ca(NO2)2的副产品,工业流程如图所示。
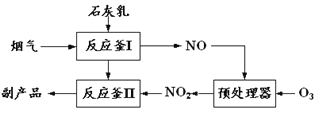
①反应釜I采用“气—液逆流”接触吸收法(如图),其优点是_____。
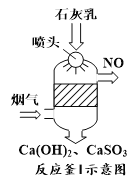
②反应釜II中CaSO3转化为CaSO4的化学反应方程式为_____。
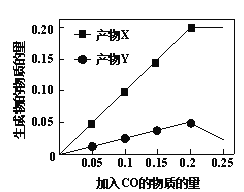
(2)为研究“CO还原SO2”的新技术,在反应器中加入0.10 mol SO2,改变加入CO的物质的量,反应后体系中产物随CO的变化如图所示。其中产物Y的化学式是____。
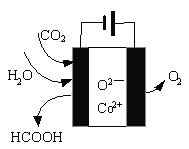
(3)O2/CO2燃烧技术是指化石燃料在O2和CO2的混合气体中燃烧而不是在空气中燃烧,通过该燃烧技术可收集到高纯度的CO2。
①与在空气中燃烧相比,利用O2/CO2燃烧技术,烟气中NOx的排放量明显降低,其主要原因是_____。
②利用太阳能可实现反应:2CO2(g)=2CO(g)+O2(g),该反应能自发进行的原因是______。
③700℃时,以Ni-MgO/γ-Al2O3作催化剂,向2 L密闭容器中通入CO2和CH4各3 mol,发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____。
2CO(g)+2H2(g),反应达平衡时测得 CO的体积分数为40%,CO2的平衡转化率为_____。
④CO2在新型钴基电催化剂作用下可转化为清洁燃料—甲酸。其工作原理如图所示,写出生成甲酸的电极反应式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com