
科目: 来源: 题型:
【题目】C、H、N这三种化学元素在组成人体的化学成分中,质量分数共占73%左右,而这三种元素在岩石圈中质量分数还不到1%.这个事实说明了( )
A. 生物界与非生物界具有统一性
B. 生物界与非生物界具有差异性
C. 元素在自然界中都可以找到
D. 生物界具有特殊性
查看答案和解析>>
科目: 来源: 题型:
【题目】把碘从碘水里分离出来,有下列基本操作:①静置后分液;②把碘水倒入分 液漏斗;③加入萃取剂四氯化碳,再充分振荡。正确的操作顺序是( )
A.①②③B.③②①
C.②③①D.③①②
查看答案和解析>>
科目: 来源: 题型:
【题目】在某容积一定的密闭容器中,有下列可逆反应:A(g)+B(g)xC(g),有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T表示温度,P表示压强,C%表示C的体积分数)( ) 
A.P3<P4 , y轴表示B的体积分数
B.P3<P4 , y轴表示混合气体的密度
C.P3>P4 , y轴表示B的百分含量
D.P3>P4 , y轴表示混合气体的平均摩尔质量
查看答案和解析>>
科目: 来源: 题型:
【题目】在一定温度下,将气体X和气体Y各0.16mol充入10L 恒容密闭容器中,发生反应:X(g)+Y(g)═2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
A.反应前2min的平均速率ν(Z)=2.0×10﹣5 mol/(Lmin)
B.4min时,ν(逆)>ν(正)
C.该温度下,此反应的平衡常数K=1.44
D.7min时,反应还未达到平衡状态
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组探究铁和硝酸银溶液的反应,实验过程如下:
实验序号 | 实验操作 | 实验现象 |
I | 将一束光亮洁净的铁丝伸入到0.1mol/L 的AgNO3溶液中 | 铁丝表面有银白色固体析出,溶液逐渐变为浅绿色 |
II | 取少量实验I中上层清液,滴入K3[Fe(CN) 6]溶液 | 有蓝色沉淀生成 |
(1)根据上述实验现象,甲同学认为有Fe2+生成,铁和硝酸银溶液的反应的离子方程式是____________________。
(2)乙同学认为实验中可能生成Fe3+,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
III | 取少量实验I中上层清液,滴入少量KSCN溶液,振荡 | 产生白色沉淀,溶液局部变红,振荡后红色消失,沉淀量增加 |
查阅资料:Ag+与SCN-生成白色沉淀AgSCN
乙同学判断有Fe3+,理由是 ____________________。
(3)乙同学继续探究红色褪去的原因,设计并完成如下实验
实验序号 | 实验操作 | 实验现象 |
IV | 取少量实验I中上层清液,滴加几滴稀盐酸 | 有白色沉淀生成 |
V | 取1mLFe(NO3)3溶液,滴加2滴等浓度的KSCN溶液,振荡,再滴加少量AgNO3溶液 | 溶液变红;振荡溶液颜色无变化,滴加AgNO3后溶液红色褪去,产生白色沉淀. |
① 实验IV的目的是____________________;
② 用平衡移动原理解释,实验V中溶液红色褪去的原因____________________。
(4)丙认为溶液中Fe3+是Fe2+被Ag+氧化所致。按下图连接装置并进行实验,一段时间后取出左侧烧杯溶液加入KSCN溶液,溶液变红
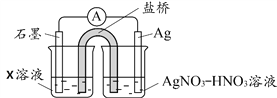
① 其中X溶液是____________________;
② 由实验得出Ag+和Fe2+反应的离子方程式是____________________;
③ 丙同学的实验设计及结论是否合理,请说明理由____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】联合国卫生组织认为我国使用的铁锅是有益于人类健康的理想炊具。其主要原因是( )
A. 价格便宜,不易生锈 B. 铁具有银白色光泽,导电性好
C. 烹调的食物中留有人体需要的铁元素 D. 传热慢,保温性能好
查看答案和解析>>
科目: 来源: 题型:
【题目】将面团包在纱布中在清水中搓洗,鉴定留在砂布上的粘稠物质和洗出的白浆用的试剂分别是
A. 碘液、苏丹Ⅲ染液 B. 双缩脲试剂、碘液
C. 亚甲基蓝溶液、苏丹Ⅲ染液 D. 碘液、斐林试剂
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是部分短周期元素最外层电子数与原子序数的关系图. 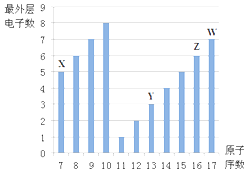
请回答下列问题:
(1)画出Z的原子结构示意图 .
(2)原子半径:YZ(填“>”、“<”).
(3)Y的最高价氧化物的水化物与氢氧化钠溶液反应的化学方程式为 .
(4)X的最高价氧化物的水化物的化学式为 .
(5)画出W的氢化物的电子式 .
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①能量越低的物质就越稳定,②白磷转化成红磷是放热反应。据此,下列说法不正确的是
A.在相同的条件下,红磷比白磷稳定B.红磷和白磷的结构不同,互为同位素
C.白磷分子之间存在范德华力D.白磷容易发生自燃而红磷则不易自燃
查看答案和解析>>
科目: 来源: 题型:
【题目】钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)钛铁矿在预处理时需要进行粉碎,其原因是___________________。
(2)过程①中反应的离子方程式是: FeTiO3 + 4H++ 4Cl-== Fe2+ + TiOCl42-+ 2H2O、_______。
(3)过程①中,铁的浸出率结果如图1所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是___________________。

(4)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图2所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(5)在滤液B转化为FePO4沉淀过程中发生以下反应,请配平:
Fe2+ +_____ + H3PO4 ===FePO4 + ____ + _____
(6)过程③中由FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com