
科目: 来源: 题型:
【题目】高铁酸盐在水溶液中有四种含铁型体,250C时,它们的物质的量分数随PH的变化如图所示,下列叙述错误的是
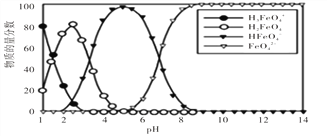
A. 向pH=5的高铁酸盐溶液中加入NaOH溶液,离子方程式为:HFeO4-+OH-=FeO42-+H2O
B. 为获得尽可能纯净的高铁酸盐,应控制pH≥9
C. 已知H3FeO4+的电离平衡常数分别为:K1=2.5×10-2 ,K2=4.8×10-4,K3=5.0×10-8,当pH=4时,溶液中c(HFeO4-)/c(H2FeO4)=1.2
D. pH=2时,溶液中含铁粒子浓度的大小关系为:c(H2FeO4)>c(H3FeO4+)>c(HFeO4-)
查看答案和解析>>
科目: 来源: 题型:
【题目】N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 molN-N键吸收193kJ能量,形成N2(g)中1 mol N![]() N放出941 kJ能量。下列说法正确的是
N放出941 kJ能量。下列说法正确的是

A. N4(g)比N2(g)更稳定
B. N4(g)=2N2(g) △H=+724kJmol-1
C. 形成1 mol N4(g)中的化学键放出193 kJ的能量
D. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
查看答案和解析>>
科目: 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体V L(标准状况),向反应后的溶液中(存在Cu2+和SO42﹣)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO 12.0g,若上述气体为NO和NO2的混合物,且体积比为1:1,则V可能为( )
A.7.5 L
B.12.3 L
C.15.7 L
D.16.8 L
查看答案和解析>>
科目: 来源: 题型:
【题目】有三种有机物的分子式均为C8H8,其键线式分别表示为X:![]() ,Y:
,Y:![]() ,Z:
,Z:![]() 。下列说法正确的是
。下列说法正确的是
A. X、Z分子中所有原子一定在同一平面内
B. X、Y、Z都能发生取代反应、加成反应和氧化反应
C. X、Y、Z互为同分异构体,它们二氯代物的同分异构体数目不相同
D. X、Y、Z都能使酸性高锰酸钾溶液褪色,也能使溴的四氯化碳溶液褪色
查看答案和解析>>
科目: 来源: 题型:
【题目】某化学小组为了研究外界条件对化学反应速率的影响,进行了如下实验:
(实验原理)2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O
(实验内容及记录)
实验编号 | 实验温度 | 试管中所加试剂及其用量/mL | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | |||
① | 25 | 3.0 | V1 | 2.0 | 3.0 | 1.5 |
② | 25 | 2.0 | 3.0 | 2.0 | 3.0 | 2.7 |
③ | 50 | 2.0 | V2 | 2.0 | 3.0 | 1.0 |
(1)请完成此实验设计,其中:V1=________,V2=__________。
(2)实验①、②探究的是_____________对化学反应速率的影响,根据上表中的实验数据,可以得到的结论是______________________________________。
(3)探究温度对化学反应速率的影响,应选择________________(填实验编号)。
(4)利用实验1中的数据,计算用KMnO4表示的化学反应速率为__________。
(5)该小组同学根据经验绘制了n(Mn2+)随时间变化的趋势如图1所示,但有同学查阅已有的实验资料发现,该实验过程中n(Mn2+)随时间变化的实际趋势如图2所示。

该小组同学根据图2所示信息提出了新的假设,并设计以下实验方案继续进行实验探究。
实验编号 | 实验温度/℃ | 试管中所加试剂及其用量 | 再向试管中加入某种固体 | 溶液褪至无色所需时间/min | |||
0.6mol/L H2C2O4溶液 | H2O | 3mol/L 稀H2SO4溶液 | 0.05mol/L KMnO4溶液 | ||||
④ | 25 | 2.0 | 3.0 | 2.0 | 3.0 | MnSO4 | t |
①该小组同学提出的假设是__________________________________________。
②若该小组同学提出的假设成立,应观察到_____________________________现象。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,pH=l 的某溶液 A 中除H+外,还含有NH4+、K+、Na+、Fe3+、Al3+、Fe2+、CO32-、NO3-、 Cl-、I-、SO42-中的4种,且溶液中各离子的物质的量浓度均为0.1mol·L-1。现取该溶液进行有关实验,实验结果如下图所示,下列有关说法正确的是

A. 该溶液中一定有上述离子中的NO3-、Al3+、SO42-、Cl-四种离子
B. 实物消耗Cu14.4g,则生成气体丁的体积为3.36L
C. 该溶液一定没有Fe3+,但是无法确定是否含有I-
D. 沉淀乙一定有BaCO3,可能有BaSO4
查看答案和解析>>
科目: 来源: 题型:
【题目】下面是甲、乙、丙三位同学制取乙酸乙酯的过程,请你参与并协助他们完成相关实验任务。
【实验目的】制取乙酸乙酯
【实验原理】甲、乙、丙三位同学均采取乙醇、乙酸与浓硫酸混合共热的方法制取乙酸乙酯。
【装置设计】甲、乙、丙三位同学分别设计了下列三套实验装置:
请从甲、乙两位同学设计的装置中选择一种作为实验室制取乙酸乙酯的装置,较合理的是________(选填“甲”或“乙”)。丙同学将甲装置进行了改进,将其中的玻璃管改成了球形干燥管,除起冷凝作用外,另一重要作用是_______。
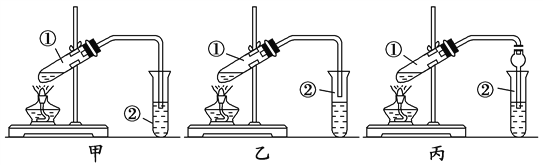
【实验步骤】
(1)用酒精灯对试管①加热;(2)将试管①固定在铁架台上(3)按所选择的装置组装仪器,在试管①中先加入3 mL乙醇,并在摇动下缓缓加入2 mL浓硫酸充分摇匀,冷却后再加入2 mL冰醋酸;(4)在试管②中加入适量的饱和Na2CO3溶液;(5)当观察到试管②中有明显现象时停止实验。
【问题讨论】
a.用序号写出该实验的步骤____________;
b.装好实验装置,加入药品前还应检查____________;
c.写出试管①发生反应的化学方程式(注明反应条件) _____________________;
d.试管②中饱和Na2CO3溶液的作用是_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】X、Y、Z三种短周期元素,它们的原子序数之和为16。X、Y、Z三种元素常见单质在常温下都是无色气体,在适当条件下可发生如下图所示变化:

已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)Y元素在周期表中的位置是______;X、Y原子半径的大小:X______Y(填“>”、“<”或“=”)
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入______(填物质名称);负极电极反应式为______。
(3)C在一定条件下反应生成A的化学方程式是___________________。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0.将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是______(填写下列各项的序号)。
a.达到化学平衡的过程中,混合气体平均相对分子质量减小
b.反应过程中,Y的单质的体积分数始终为50%
c.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
d. 达到化学平衡时,正反应速率与逆反应速率相等
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com