
科目: 来源: 题型:
【题目】有关物质的转化关系如下图所示。A是生石灰的主要成分,B是一种具有漂白性的无色气体,D是一种常见的无色液体,F是某种补血剂的有效成分,G是一种常见的强酸,H的摩尔质量为72 g·mol-1。

(1)A的化学式为____________。
(2)D的电子式为____________。
(3)写出反应①的化学方程式:________________________。
(4)写出反应②的离子方程式:________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组物质中,物质之间通过一步反应就能实现图示变化的是( )
物质编号 | 物质转化关系 | a | b | c | d |
① |
| NO | NO2 | N2 | HNO3 |
② | Na2O | Na2O2 | Na | NaOH | |
③ | FeCl2 | FeCl3 | Fe | CuCl2 | |
④ | Al2O3 | NaAlO2 | Al | Al(OH)3 |
A.①②③
B.①③④
C.③④
D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)认识有机化合物的结构与类别有助于理解其性质。
①下列有机化合物与苯甲酸(![]() )互为同系物的是________(填字母,下同)。
)互为同系物的是________(填字母,下同)。
a. 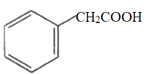 b.
b. 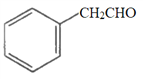 c.
c. 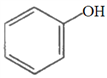
②下列有机化合物易溶于水的是________。
a. 苯 b. 乙烷 c. 乙醇
③下列试剂可用于鉴别乙酸和乙醛的是________。
a. 水 b. 银氨溶液 c. 稀硫酸
(2)扁桃酸(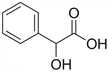 )是一种重要的化工原料。
)是一种重要的化工原料。
①扁桃酸分子中有________种不同化学环境的氢。
②扁桃酸中含氧官能团的名称为________和________。
③1 mol扁桃酸最多能与________mol金属钠反应
(3)化合物C是一种医药中间体,由A制备C的物质转化路线如下:
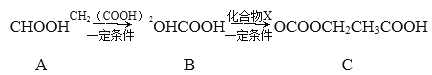
①1个A分子中一定共平面的碳原于有________个。
②B暴露在空气中易变色,其原因是___________________________________。
③化合物X的分子式为C3H5O2Cl,其结构简式为_________________________________。
④D是B的一种同分异构体。D能发生银镜反应,也能与NaHCO3溶液反应放出气体,且苯环上的一氯代物有2种。写出符合条件的D的一种结构简式:________。
查看答案和解析>>
科目: 来源: 题型:
【题目】人体内磷脂的重要生理作用是( )
A. 细胞膜结构的重要成分 B. 氧化分解为机体提供能量
C. 合成维生素D和脂肪的原料 D. 有利于脂溶性物质的吸收
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)改善空气质量、保护水土资源是实现美丽中国的基础。
①下列气体的排放会导致酸雨形成的是________(填字母,下同)。
a. CH4 b. CO c. SO2
②下列处理废水的方法属于中和法的是________。
a. 用熟石灰处理废水中的酸
b. 用臭氧处理废水中的氰化物
c. 用铁粉回收废水中的铜
③下列做法会造成土壤重金属污染的是________。
a. 作物秸杆露天焚烧
b. 废干电池就地填埋
c. 废旧塑料随意丢弃
(2)新鲜牛肉含蛋白质、脂肪、糖类、维生素A、维生素C、钙、铁等,其中:
①属于人体所需微量元素的是________。
②属于脂溶性维生素的是________。
③可为人体提供能量的是________、________和________。
(3)材料的发展与应用促进了人类社会的进步。
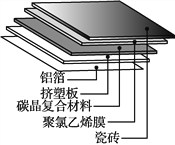
①碳晶地暖环保、节能、安全,其构造如图所示。其中属于金属材料的是________;属于硅酸盐材料的是________;属于高分子材料的是挤塑板和________。
②吸附材料具有多孔、表面积大的特点。活性炭吸附NO2的过程中,会伴有C与NO2的反应,产物为两种常见无毒气体。写出该反应的化学方程式:_________________________________________。
③LiMn2O4是锂离子电池的一种正极材料,可通过MnO2与Li2CO3煅烧制备,同时还生成CO2和一种单质。写出该反应的化学方程式:_______________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),下面列举了一些化学键的键能数据,供计算使用
化学键 | Si﹣O | Si﹣Cl | H﹣H | H﹣Cl | Si﹣Si | Si﹣C |
键能/kJ.mol﹣1 | 460 | 360 | 436 | 431 | 176 | 347 |
工业上的高纯硅可通过下列反应制取:SiCl4(g)+2H2(g)Si(s)+4HCl(g),该反应的逆反应的△H为 ( )
A. ﹣236 kJmol﹣1 B. ﹣412 kJmol﹣1 C. +236 kJmol﹣1 D. +412 kJmol﹣1
查看答案和解析>>
科目: 来源: 题型:
【题目】已知铜和浓硫酸可以在加热条件下发生如下反应(反应方程式已配平):Cu+2H2SO4(浓)![]() CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
CuSO4+A↑+2H2O。试通过计算和推理完成下面的问题:
(1)A物质可以导致酸雨的形成。则A应该属于________(用字母代号填写)
a. 酸 b. 碱 c. 盐 d. 酸性氧化物 e. 碱性氧化物
A物质可以使酸性KMnO4溶液褪色,此反应中________(填写化学式,下同)失去电子,氧化剂是__________。
(2)一定量的铜片与100mL 18 mol/L的浓H2SO4充分反应,如果该反应过程中转移了0.2mol电子,生成的CuSO4的质量为_____g,生成的A气体在标准状况下体积为_____L(假设气体全部逸出),剩余的H2SO4的浓度为____________mol/L(忽略溶液体积的变化)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验:
Ⅰ.探究同周期元素性质的递变规律
(1)相同条件下,将钠、镁、铝各1 mol分别投入到足量的同浓度的稀盐酸中,试预测实验结果:_______与稀盐酸反应最剧烈;______与稀盐酸反应产生的气体最多。
(2)向Na2SiO3溶液中加入稀H2SO4出现白色沉淀,可证明S的非金属性比Si强,反应的离子方程式为_____________________________。
Ⅱ.探究同主族元素非金属性的递变规律
某研究性学习小组设计了一组实验来探究ⅦA族元素原子的得电子能力强弱规律。下图中A、B、C是三个可供选择制取氯气的装置,装置D的玻璃管中①、②处依次放置蘸有NaBr溶液、NaOH浓溶液的棉球。

(3)写出装置B中仪器a的名称 ________________。
(4)实验室制取氯气还可采用如下原理:2KMnO4+16HCl(浓)===2KCl+2MnCl2+5Cl2↑+8H2O,依据该反应原理选择_____________(填“A”或“B”或“C”)装置制取氯气。
(5)反应装置的导气管连接装置D的X导管,①处发生反应的离子方程式为________________________;
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)工业上用洗净的废铜屑作原料来制备硫酸铜。下列制备方法符合“绿色化学”思想的是_________(填序号)。
①![]() ②
②![]()
写出①中反应的化学方程式:_____________________。
(2)SO2被称为“空中死神”,其对环境的危害常表现为__________________。为了减少危害,人们进行了许多有益的探索和研究,并且在实际应用上取得了一定的成果。工业上常用生石灰来处理煤炭中的SO2,这是利用了SO2属于__________氧化物的性质。
(3)硫元素是一种常见的非金属元素,硫原子的原子结构示意图为_______,自然界中存在的某种单质以八个原子结合,其分子式为_______。
(4)氮元素是大气中含量最高的元素,其单质的电子式___________。由于该单质比较稳定,只能与部分活泼金属反应,比如在点燃条件下,可与金属镁反应,试写出该反应方程式___________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com