
科目: 来源: 题型:
【题目】X、Y、Z、M、R为五种短周期元素,其原子半径和最外层电子数之间的关系如图所示。下列说法正确的是( )

A. 简单阳离子半径:X>R
B. X与Y可以形成正四面体结构的分子
C. M的氢化物常温常压下为液体
D. 最高价氧化物对应水化物的酸性:Z<Y
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
A. C2H4、C2H6O B. C2H6、C2H6O C. C3H6、C2H4 D. C3H4、C2H6O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A.化学平衡常数是受溶液的浓度、气体的压强、体系的温度等外界条件影响的
B.某电解质溶液中,温度升高,Kw增大,则溶液的酸性或碱性一定增强
C.H2CO3的电离常数表达式:K= ![]()
D.电离平衡常数可以表示弱电解质的相对强弱
查看答案和解析>>
科目: 来源: 题型:
【题目】下述实验中均有红棕色气体产生,对比分析所得结论错误的是
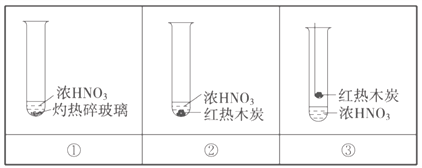
A. 红棕色气体不能表明②中木炭与浓硝酸产生了反应
B. 由①中的红棕色气体,推断产生的气体一定是混合气体
C. 由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D. ③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应
查看答案和解析>>
科目: 来源: 题型:
【题目】氨气在工农业生产和国防科技中有着重要应用,科研工作者对其进行着广泛研究。请回答:
(1)某课题组实现了在常温常压下,以氮气和液态水为原料制备氨气,同时有氧气生成。
已知,在一定温度和压强下,由最稳定的单质生成1mol纯物质的热效应,称为该物质的生成热(△H)。常温常压下、相关物质的生成热如下表所示:
物质 | NH3(g) | H2O(l) |
△H /kJ·mol-1 | -46 | -242 |
上述合成氨反应的热化学方程式为______________________________________。
(2)利用生物电池,以H2、N2为原料合成氨的装置如下图所示。

Q、R均为能化剂,据图示判断,负极反应的催化剂为______(填“Q”或“R”);正极的电极反应式为_________________________________________。
(3)氨气是工业制硝酸的主要原料之一,催化氧化步骤中发生的主要反应如下:
I. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)△H=-906kJ/mol
4NO(g)+6H2O(g)△H=-906kJ/mol
II.4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g)△H=-1266kJ/mol
2N2(g)+6H2O(g)△H=-1266kJ/mol
将固定比例NH3和O2 的混合气体以一定流速通过填充有催化剂的反应器,反应产率与温度的关系如图1所示。
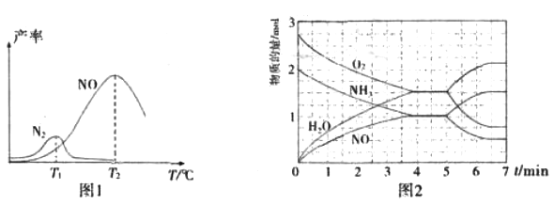
①催化氧化步骤中,最适宜的温度为_________________(填“T1”或“T2”)。
②低于T1℃时,NO的产率较低的原因为_____________________________________。
③高于T2℃时,NO的产率降低的可能原因为______________(填选项字母)
A.催化剂活性降低 B.平衡常数减小
C.反应活化能增大 D.氨气溶于水
④T2℃(T1>T2)时,向20L恒容密闭容器中充人2molNH3和2.75molO2,发生反应
I.反应过程中各物质的物质的量的随时间(t)变化关系如图2所示。
T2℃时,该反应的平衡常数K=________________;5min时,改变了某一外界条件,所改变的条件可能为_________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:2FeSO4·7H2O![]() Fe2O3+SO2↑+SO3↑+14H2O↑,用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
Fe2O3+SO2↑+SO3↑+14H2O↑,用下图所示装置检验FeSO4·7H2O的所有分解产物,下列说法不正确的是
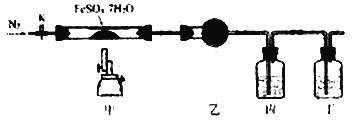
A. 乙、丙、丁中可依次盛装无水CuSO4、Ba(NO3)2溶液、品红溶液
B. 实验时应先打开K,缓缓通入N2,再点燃酒精喷灯
C. 甲中残留固体加稀硫酸溶解,再滴加KSCN,溶液变红
D. 还应在丁装置后面连接盛有NaOH溶液的洗气瓶
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是 ( )
A. 所有细胞中的化合物的含量是一样的
B. 所有细胞中化合物的种类都一样
C. 各种细胞中的元素种类完全一致
D. 细胞中都有蛋白质和核酸
查看答案和解析>>
科目: 来源: 题型:
【题目】用酸式滴定管准确移取25.00mL某未知浓度的盐酸溶于一洁净的锥形瓶中,然后用0.2000molL ﹣1的氢氧化钠溶液(指示剂为酚酞),滴定结果如下:
NaOH起始读数 | NaOH终点读数 | |
第一次 | 0.10mL | 18.60mL |
第二次 | 0.30mL | 18.00mL |
(1)根据以上数据可以计算出盐酸的物质的量浓度为molL﹣1 .
(2)达到滴定终点的标志是 .
(3)以下操作造成测定结果偏高的原因可能是 .
A.配制标准溶液的氢氧化钠中混有Na2CO3杂质
B.滴定终点读数时,俯视滴定管的刻度,其它操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定到终点读数时发现滴定管尖嘴处悬挂一滴溶液
E.未用标准液润洗碱式滴定管.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com