
科目: 来源: 题型:
【题目】生产上用过量烧碱溶液处理某矿物(含Al2O3、MgO),过滤后得到滤液用NaHCO3溶液处理,测得溶液pH和Al(OH)3生成的量随加入NaHCO3溶液体积变化的曲线如下:

下列有关说法不正确的是
A. 原NaHCO3溶液中c(H2CO3)+c(HCO3-)+c(CO32-)=0.8moL/L
B. a点水的电离程度小于c点水的电离程度
C. a点溶液中存在:c(Na+)+c(H+)=c(AlO2-)+(OH-)
D. 生成沉淀的离子方程式为:HCO3-+AlO2-+H2O=Al(OH)3↓+CO32-
【答案】A
【解析】A. 据图可知,加入40mLNaHCO3溶液时生成沉淀最多,沉淀为0.032mol,因NaOH过量,则滤液中含有NaOH,由反应顺序OH+HCO3=CO32+H2O、HCO3+AlO2+H2O═Al(OH)3↓+ CO32并结合图象可知,加入前8mLNaHCO3溶液时不生成沉淀,则原NaHCO3溶液中c(NaHCO3)= ![]() =1.0mol/L,所以c(H2CO3)+c(HCO3-)+c(CO32-)=1.0moL/L,故A错误;B. a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,故B正确;C. a点对应的溶液为加入过量烧碱后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO2-)+(OH-),故C正确;D. 由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为:HCO3+AlO2+H2O═Al(OH)3↓+ CO32,故D正确;答案选A。
=1.0mol/L,所以c(H2CO3)+c(HCO3-)+c(CO32-)=1.0moL/L,故A错误;B. a点时尚未加入NaHCO3溶液,滤液中NaOH过量,水的电离受到抑制,随NaHCO3溶液的加入,溶液中NaOH逐渐减少,水的电离程度逐渐增大,所以a点水的电离程度小于c点水的电离程度,故B正确;C. a点对应的溶液为加入过量烧碱后所得的滤液,因氧化镁与NaOH溶液不反应,则加入过量烧碱所得的滤液中含有NaOH和NaAlO2,由电荷守恒可知c(Na+)+c(H+)=c(AlO2-)+(OH-),故C正确;D. 由上述分析可知,加入NaHCO3溶液生成沉淀的离子方程式为:HCO3+AlO2+H2O═Al(OH)3↓+ CO32,故D正确;答案选A。
【题型】单选题
【结束】
8
【题目】芳香化合物在催化剂催化下与卤代烃发生取代反应称为Friedel-Crafts烷基化反应。某科研小组以苯和氯代叔丁烷[ClC(CH3)3]为反应物,无水AlCl3为催化剂条件下制备叔丁基苯(![]() )。
)。
反应如下: +ClC(CH3)3
+ClC(CH3)3 +HCl
+HCl
已知下列信息:
物质 | 相对分子质量 | 密度 | 熔点 | 沸点 | 溶解性 |
AlCl3 | —— | —— | 190℃ | 180℃ | 遇水极易潮解并产生白色烟雾,微溶于苯 |
苯 | 78 | 0.88g/cm3 | —— | 80.1℃ | 难溶于水,易溶于乙醇 |
氯代叔丁烷 | 92.5 | 1.84 g/cm3 | —— | 51.6℃ | 难溶于水,可溶于苯 |
叔丁基苯 | 134 | 0.87 g/cm3 | —— | 169℃ | 难溶于水,易溶于苯 |
I、如下图是实验室制备无水AlCl3的实验装置:

(1)E装置中的仪器名称是_______________。
(2)写出B装置中发生反应的离子方程式:________________________。
(3)选择合适的装置制备无水AlCl3正确的连接顺序为:_____________ (写导管口标号)。
(4)下列操作正确的是________。
甲:先加热硬质玻璃管再加热圆底烧瓶
乙:先加热圆底烧瓶再加热硬质玻璃管
(5)E装置的作用是:_______________________。
II、实验室制取叔丁基苯装置如图:

在三颈烧瓶中加入50mL的苯和适量的无水AlCl3,由恒压漏斗滴加氯代叔丁烷[ClC(CH3)3]10mL,一定温度下反应一段时间后,将反应后的混合物洗涤分离,在所得产物中加入少量无水MgSO4固体,静置,过滤,蒸馏得叔丁基苯20g。
(6)使用恒压漏斗的优点是____________________;加无水MgSO4固体的作用是___________。
(7)上述反应后混合物的洗涤所用的试剂有如下三种,正确的顺序是_____________。
①5%Na2CO3溶液 ②稀盐酸 ③H2O
(8)叔丁基苯的产率为______。(保留3位有效数字)
查看答案和解析>>
科目: 来源: 题型:
【题目】CuSO4是一种重要的化工原料, 其有关制备途径及性质如图所示,其中混合气体 X中含有SO2、SO3。下列说法不正确的是

A. 途径①所用混酸中 H2SO4与 HNO3物质的量之比最好为 3∶2
B. 相对于途径①、 ③,途径②更好地体现了绿色化学思想
C. 1 mol CuSO4在 1100℃所得混合气体X中O2为 0.75 mol
D. Y 可以是葡萄糖
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素 W、X、Y、Z 的原子序数依次递增,a、b、c、d、e、f 是由这些元素组成的化合物,d为淡黄色的离子化合物,m为元素Y的单质,通常为无色无味的气体。上述物质的转化关系如图所示。下列说法正确的是
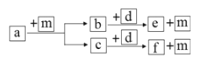
A. 原子半径: W<X<Y<Z
B. 阴离子的还原性: Y>W
C. 图中物质的转化过程均为氧化还原反应
D. a 一定由 W、X 两种元素组成
查看答案和解析>>
科目: 来源: 题型:
【题目】元素周期表中第四周期元素有许多重要用途。
I.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。
(1) 基态V元素的价层电子轨道表示式为___________,分子中非金属元素电负性由大到小的顺序为______________。
(2) 分子中采取sp2杂化的原子有_________,1mol 分子中含有配位键的数目是______。
(3) 该物质的晶体中除配位键外,所含微粒间作用力的类型还有______ (填序号)。
a. 金属键 b.极性键 c.非极性键 d.范德华力 e. 氢键
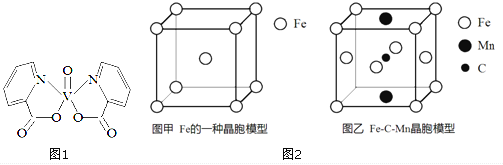
II.Fe 与C、Mn等元素可形成多种不同性能的合金。
(4) 图2-甲是Fe的一种晶胞,晶胞中Fe 的堆积方式为________,己知该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的边长为__________cm。
(5) 图2-乙是Fe-C-Mn 合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe 的个数为___,该合金的化学式为__________。
【答案】 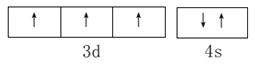 O>N>C>H C、N 2NA bcd 体心立方密堆积
O>N>C>H C、N 2NA bcd 体心立方密堆积 ![]() 4 Fe23Mn8C8
4 Fe23Mn8C8
【解析】I. (1). V是23号元素,其价层电子排布式为3d34s2,价层电子轨道表示式为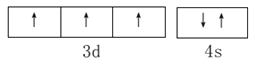 ,由图1可知,该配合物中含有N、O、C、H四种非金属元素,由元素周期律可知,这四种元素的非金属性O>N>C>H,非金属性越强,电负性越大,则电负性由大到小的顺序为:O>N>C>H,故答案为:
,由图1可知,该配合物中含有N、O、C、H四种非金属元素,由元素周期律可知,这四种元素的非金属性O>N>C>H,非金属性越强,电负性越大,则电负性由大到小的顺序为:O>N>C>H,故答案为: ;O>N>C>H;
;O>N>C>H;
(2). 由图1可知,该分子中的C原子和N原子的σ键数均为3且没有孤电子对,所以C原子和N原子的杂化轨道数目均为3,采取sp2杂化,由图1可知,V与N原子之间形成配位键,1个分子中含有2个配位键,则1mol分子中含有2mol配位键,数目为2NA,故答案为:C、N;2NA;
(3). 该物质是电中性分子,分子之间存在范德华力,由图1可知,该物质的晶体中除配位键外,分子内的不同非金属原子之间形成极性共价键,同种非金属原子之间形成非极性共价键,不存在金属键和氢键,故答案为:bcd;
II. (4). 由Fe的晶胞结构示意图可知,晶胞中Fe的堆积方式为体心立方密堆积,晶胞中Fe原子的个数为:8×![]() +1=2,则晶胞的质量为:
+1=2,则晶胞的质量为:![]() ×56g,设晶胞的棱长为x cm,则
×56g,设晶胞的棱长为x cm,则![]() ×56g=ρg·cm-3×(x cm)3,解得x=
×56g=ρg·cm-3×(x cm)3,解得x=![]() cm,故答案为:体心立方密堆积;
cm,故答案为:体心立方密堆积;![]() ;
;
(5). 由图乙可知,体心的C原子与面心的Fe原子距离最近,则与C原子等距紧邻的Fe原子个数为4,该晶胞中Fe原子个数为7×![]() +4×
+4×![]() =
=![]() ,C原子个数为1,Mn原子数目为2×
,C原子个数为1,Mn原子数目为2×![]() =1,则Fe、Mn、C原子数目之比为23:8:8,化学式为:Fe23Mn8C8,故答案为:4;Fe23Mn8C8。
=1,则Fe、Mn、C原子数目之比为23:8:8,化学式为:Fe23Mn8C8,故答案为:4;Fe23Mn8C8。
点睛:本题主要考查物质结构和性质,涉及电子排布式、电负性、杂化方式、配合物、晶胞结构和有关计算,试题难度不大。本题的易错点是第(5)小题,在利用均摊法计算晶胞中原子个数时,要注意该晶体有缺陷,即有一个顶点未排列Fe原子。
【题型】综合题 【题目】香料G的一种合成工艺如下图所示。
【结束】
12
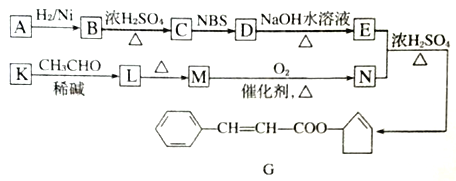
A 的分子式为C5H8O其核磁共振氢谱显示有两种峰。其峰面积之比为1: 1.
已知:CH3CH2CH=CH2![]() CH3CHBrCH=CH2
CH3CHBrCH=CH2
CH3CHO+CH3CHO![]()
![]()
![]()
![]() CH3CH=CHCHO+H2O
CH3CH=CHCHO+H2O
请回答下列问题:
(1)G中含氧官能团的名称为_______,B生成C的反应类型为_________。
(2)A的结构简式为_______。
(3)写出下列转化的化学方程式:D→E_____________________
(4)有学生建议,将M→N的转化用KMnO4(H+)代替O2,老师认为不合理,原因是_______。
(5)F是M的同系物,比M多一个碳原子。满足下列条件的F的同分异构体有____种。(不考虑立体异构),其中核磁共振氢谱显示5组峰的结构简式为_______、________。
①能发生银镜反应 ②能与溴的四氯化碳溶液加成 ③苯环上有2个取代基
(6) 以2-丙醇和NBS试剂为原料制备甘油(丙三醇),请设计合成路线(其他无机原料任选)__________。
请用以下方式表示: ![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】砷元素广泛存在于自然界,砷与其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O3转化为As2O5的热化学方程式__________________________________。

(2)砷酸钠具有氧化性,298K时,在100mL烧杯中加入10mL0.1 mol/L Na3AsO4溶液、20mL0.1 mol/L KI溶液和20mL0.05mol/L硫酸溶液,发生下列反应:AsO43-(无色)+12(浅黄色)+H2O △H。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①升高温度,溶液中AsO43-的平衡转化率减小,则该反应的△H________0(填“大于”“小于”或“等于”)。
②0~10min内,I的反应速率v(Iˉ)= ____________。
③下列情况表明上述可逆反应达到平衡状态的是_______(填字母代号)。
a.c(AsO33-)+c(AsO42-)不再变化 b.溶液颜色保持不再变化
C.c(AsO33-)与c(AsO42-)的比值保持不再变化 d.I的生成速率等于I2的生成速率
④在该条件下,上述反应平衡常数的表达式K=______________。
(3)利用(2)中反应可测定含As2O3和As2O5的试样中的各组分含量(所含杂质对测定无影响),过程如下:
①将试样02000g溶于NaOH溶液,得到含AO33-和AsO43-的混合溶液。
②上述混合液用0.02500 mol·L-1的I2溶液滴定,用淀粉试液做指示剂,当________________,则滴定达到终点。重复滴定3次,平均消耗I2溶液40.00mL。则试样中As2O5的质量分数是_________(保留四位有效数字)。若滴定终点时,仰视读数,则所测结果_________ (填“偏低”,“偏高”,“无影响”)。
【答案】 略 略 略 略 略 略 略 略
【解析】(1). 由图1可知,As2O3(s)和O2(g)反应转化为As2O5(s)的△H=-(914.6-619.2)kJ/mol=-295.4kJ/mol,则热化学方程式为:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol,故答案为:As2O3(s)+O2(g)=As2O5(s) △H=-295.4kJ/mol;
(2). ①. 升高温变,溶液中AsO43-的平衡转化率减小,说明升高温度,平衡逆向移动,该反应为放热反应,则△H<0,故答案为:小于;
②. 在0~10min 内,I2的浓度从0变为0.015mol/L,由反应方程式可知,I-减少了0.03mol/L,则0~10min内,用I-表示的反应速率v(I-)=0.03mol/L÷10min=0.003mol/(L·min),故答案为:0.003mol/(L·min);
③. a. 根据物料守恒关系可知,溶液中的c(AsO33-)+c(AsO43-)始终不变,所以c(AsO33-)+c(AsO43-)不再变化,不能说明反应达到平衡状态,故a错误;b. 溶液颜色不再变化,说明各物质的浓度不再改变,反应达到平衡状态,故b正确;c. c(AsO33-)与c(AsO43-)的比值不再变化,说明正逆反应速率相等,反应达到平衡状态,故c正确;d. I-的生成速率等于I2的生成速率,正逆反应速率不相等,说明反应没有达到平衡状态,故d错误;答案选:bc;
④. 由反应方程式可知,在该条件下,反应平衡常数的表达式K=![]() ,故答案为:
,故答案为:![]() ;
;
(3). ①. 用0.02500mol/L的I2溶液滴定含AsO33-和AsO43-的混合溶液,当滴入最后一滴标准液时,溶液由无色变蓝色,且30s内不恢复,即为滴定终点,上述混合液用0.02500mol/L的I2溶液滴定,重复滴定3次,平均消耗I2溶液40.0mL,根据As2O5+6OH=2AsO43+3H2O、AsO33-+I2+H2O ![]() AsO43-+2I-+2H+可知:
AsO43-+2I-+2H+可知:
1 1
n 0.02500mol/L×0.04L,n(AsO33-)= 0.001mol,则试样中As2O5的质量分数是![]() ×100%=50.50%,若滴定终点时仰视读数,会使读取的标准液体积偏大,n(AsO33-)偏大,则As2O5的质量分数偏小,所测结果偏低,故答案为:滴入最后一滴标准液,溶液由无色变蓝色,且30s内不恢复;50.50%;偏低。
×100%=50.50%,若滴定终点时仰视读数,会使读取的标准液体积偏大,n(AsO33-)偏大,则As2O5的质量分数偏小,所测结果偏低,故答案为:滴入最后一滴标准液,溶液由无色变蓝色,且30s内不恢复;50.50%;偏低。
【题型】综合题
结束】
11
【题目】元素周期表中第四周期元素有许多重要用途。
I.研究发现,钒元素的某种配合物可增强胰岛素降糖作用,它是电中性分子,结构如图1。
(1) 基态V元素的价层电子轨道表示式为___________,分子中非金属元素电负性由大到小的顺序为______________。
(2) 分子中采取sp2杂化的原子有_________,1mol 分子中含有配位键的数目是______。
(3) 该物质的晶体中除配位键外,所含微粒间作用力的类型还有______ (填序号)。
a. 金属键 b.极性键 c.非极性键 d.范德华力 e. 氢键
II.Fe 与C、Mn等元素可形成多种不同性能的合金。
(4) 图2-甲是Fe的一种晶胞,晶胞中Fe 的堆积方式为________,己知该晶体的密度为ρg·cm-3,用NA表示阿伏加德罗常数的值,则该晶胞的边长为__________cm。
(5) 图2-乙是Fe-C-Mn 合金(晶体有缺陷)的一种晶胞,则与C原子等距紧邻Fe 的个数为___,该合金的化学式为__________。

查看答案和解析>>
科目: 来源: 题型:
【题目】镁-过氧化氢燃料电池具有比能量高。安全方便等优点。其结构示意图如图所示、关于该电池的叙述正确的是
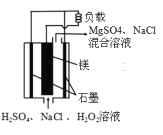
A. 该电池能在高温下正常工作
B. 电流工作时, H+向 Mg 电极移动
C. 电池工作时,正极周围溶液的pH将不断变小
D. 该电池的总反应式为: 该电池的总反应式为Mg+H2O2+H2SO4=MgSO4+2H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com