
科目: 来源: 题型:
【题目】原电池原理的发现是储能和供能技术的巨大进步,是化学对人类的一项重大贡献。
(1)将纯锌片和纯铜片按图方式插入100 mL相同浓度的稀硫酸中一段时间,回答下列问题:

①下列说法正确的是__________。
A.甲、乙均为化学能转变为电能的装置 B.乙中铜片上没有明显变化
C.甲中铜片质量减少、乙中锌片质量减少 D.两烧杯中溶液的 pH 均增大
②在相同时间内, 两烧杯中产生气泡的速度: 甲__________乙(填“>”、 “<”或“=”)。
③请写出图中构成原电池的负极电极反应式: ____________。
④当甲中溶液质量增重 31.5 克时,电极上转移电子数目为______。
(2)图丙为甲烷氧气燃料电池的构造示意图,电解质溶液的溶质是 KOH。通甲烷一极的电极反应方程式为 ______________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】乙醚(CH3CH2OCH2CH3)曾经用作麻醉剂,实验室中可将乙醇、浓硫酸的混合液加热至 140℃制取一定量的乙醚,制备原理、装置、有关物质的部分性质如下(夹持装置、加热仪器和沸石均略去):
2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O

沸点/℃ | 水溶性 | 密度(g/mL) | |
乙醇 | 78 | 混溶 | 0.8 |
乙醚 | 34.6 | 难溶 | 0.7 |
回答下列问题:
(1)温度计 X 的水银球应位于_____________________。
(2)使用仪器 B 与不使用仪器 B 相比,其优点是_____________________。
(3)所得到的乙醚中含有一定量的乙醇及酸性物质。为得到高纯度的乙醚,可依次用NaOH 溶液、水洗涤;然后用无水 CaCl2干燥,最后进行蒸馏精制。
① 洗涤操作应在_____________(填仪器名称)中进行。
② 蒸馏精制时,最好的加热方式是________________________。
③ 若实验中使用了57.5mL 无水乙醇, 最后得到乙醚 18.0mL,则乙醚的产率为_____。
(4)实验中,发现 A 中的液体会变黑; E 中的溶液会逐渐褪色,加热后又会变红。
① A 中溶液颜色变黑的原因是________________________
②乙醇、浓硫酸的混合液在加热条件下会有副反应发生,生成两种常见的无机气体,该副反应的化学方程式为______________________。
(5)要证明该反应中有 CO2生成,在 F 后面连接一个盛有澄清石灰水的洗气瓶,并将F中的液体改为______溶液。
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组用工业废料(主要含MgCO3、FeCO3和Al2O3等)回收镁的工艺流程如下:
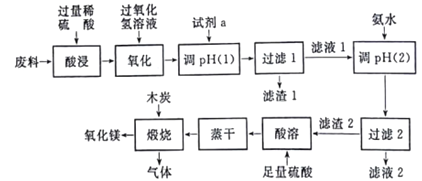
(1)酸浸过程中采用粉碎原料、加热、搅拌、适当增大硫酸的浓度等措施的目的是______;用过氧化氢溶液氧化时,发生的反应离子方程式为_________。
(2)为了不影响产品的纯度,试剂a应选择______(填编号)。
A.CuO B.Ca(OH)2 C.MgCO3 D.氨水
在用试剂a调节pH过程中,先生成的沉淀是______;当pH=5时,滤液1中Al3+和Fe3+的物质的量浓度之比为________(已知:298K时,Ksp[Al(OH)3]=3.0×10-34,Ksp[Fe(OH)3]=4.0×10-38)。
(3)写出生成滤渣2的离子方程式____________。
(4)煅烧过程存在以下反应:
2MgSO4+C=2MgO+2SO2↑+CO2↑ MgSO4+C=MgO+SO2↑+CO↑ MgSO4+3C=MgO+SO2↑+3CO↑
为测定煅烧后产生的气体中各组分含量,进行如下实验:将气体冷却至标准状况后取22.4mL气体,经Ba(OH)2溶液充分吸收,剩余7mL气体(标准状况);所得沉淀用足量硝酸溶解,再经过滤、洗涤、干燥、称量得沉淀0.1165g。则混合气体中SO2、CO2、CO体积比为_____(填最简整数比)。
查看答案和解析>>
科目: 来源: 题型:
【题目】如图为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( ) 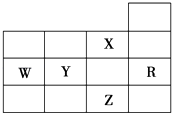
A.W元素的第一电离能小于Y元素的第一电离能
B.Y、Z的阴离子电子层结构都与R原子的相同
C.p能级未成对电子最多的是Z元素
D.X元素是电负性最大的元素
查看答案和解析>>
科目: 来源: 题型:
【题目】居室空气污染的主要来源之一是人们使用的装饰材料、胶合板、内墙涂料会释放出一种刺激性气味气体。该气体是( )
A. 甲烷 B. 甲醛 C. 氨气 D. 二氧化硫
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法中不正确的是( )
A.硫是一种黄色的能溶于水的固体
B.硫在自然界中既有化合态又有游离态存在
C.硫跟铁反应生成硫化亚铁
D.硫在空气中的燃烧产物是二氧化硫
查看答案和解析>>
科目: 来源: 题型:
【题目】室温时,1mol/L的HA和1mol/L的HB两种酸溶液,起始时的体积均为Vo,分别向两溶液中加水进行稀释,所得曲线如图所示。下列说法错误的是

A. M点溶液中c(A-)等于N点溶液中c(B-)
B. HA的电离常数约为10-4
C. 浓度均为0.1mol/L的NaA和HA混合溶液的pH<7
D. M、P两点的溶液分别用等浓度的NaOH溶液中和,消耗的NaOH溶液体积:P>M
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:A 是石油裂解气的主要产物之一,其产量常用于衡量一个国家石油化工发展水平的标志。下列是有机物 A~G 之间的转化关系:
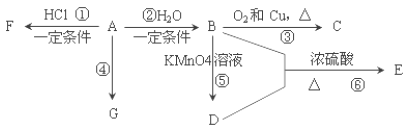
请回答下列问题:
(1)A 的官能团的名称是___________; C 的结构简式是________;
(2)E 是一种具有香味的液体, 由 B+D→E 的反应方程式为___________, 该反应类型是______________;
(3)G 是一种高分子化合物,其结构简式是______________;
(4)比赛中,当运动员肌肉挫伤或扭伤时,随队医生即对准受伤部位喷射物质 F(沸点 12.27°C)进行应急处理.写出由A 制 F 的化学反应方程式______________。
(5)E 的同分异构体能与 NaHCO3溶液反应,写出该同分异构体的结构简式_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学电源的说法不正确的是( )
A.我们可以根据硫酸密度的大小来判断铅蓄电池是否需要充电
B.燃料电池是利用燃料和氧化剂之间的氧化还原反应,将化学能转化为热能,然后再转化为电能的化学电源
C.普通锌锰干电池中,发生氧化还原反应的物质大部分被消耗后,就不能再使用了
D.由Ag2O和Zn形成的碱性银锌纽扣电池,发生电化学反应时,Zn作为负极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com