
科目: 来源: 题型:
【题目】以黄铁矿为原料制备硫酸会产生大量的废渣,合理利用废渣可以减少环境污染,变废为宝。工业上,可利用废渣(含Fe2+、Fe3+的硫酸盐及少量 CaO和MgO)制备高档颜料铁红(Fe2O3) 和回收(NH4)2SO4,具体生产流程如下。
已知:铵黄铁矾的化学式为(NH4)2Fe6(SO4)4(OH)12。
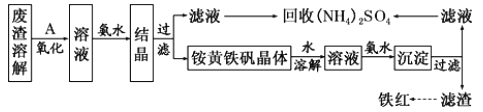
(1)在废渣溶解操作时,应选用________溶解(填字母)。
A.氨水 B.氢氧化钠溶液 C.盐酸 D.硫酸
(2)为了提高废渣溶解时的浸取效率,可采用的措施有哪些?___________________(写出一点即可)。
(3)物质A 是一种氧化剂,工业上一般选用空气,其理由是___________。氧化过程中发生反应的离子方程式为_________________。
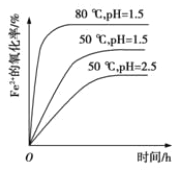
(4)根据下图有关数据,你认为工业上氧化操作时应控制的最佳温度和pH是:______。
(5) 铵黄铁矾中 可能混有的 杂质有 Fe(OH)3、____________。 铵黄铁矾与氨水反应的离子方程式为______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酰氯(SO2Cl2)是一种重要的化工试剂,氯化法是合成硫酰氯(SO2Cl2)的常用方法。实验室合成硫酰氯的实验装置如下图所示(部分夹持装置未画出);

已知:①SO2(g)+Cl2(g)=SO2Cl2 △H=-97.3kJ/mol。
②常溫下硫酰氯为无色液体,熔点-54.1℃,沸点69.1℃,在潮湿空气中“发烟”。
③100℃以上或长时间存放硫酰氯都易分解,生成二氧化硫和氧气。
回答下列问题:
(1)硫酰氯在潮湿空气中“发烟”的原因___________(用化学方程式表示)。
(2)装置B中盛放的试剂是________;仪器D的名称为________。
(3)装置E的作用是_____,E中冷凝水的入口是____(填“a”或“b”);整套装置存在的一处缺陷是_______。
(4)当装置A中生成氯气1.12L(已折算成标准状况)时,硫酰氯的产率为44%,则最终得到纯净的硫酰氯_______g。
(5)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯与另外一种物质,该反应的化学方程式为___________________,分离两种产物的方法是______________。
(6)硫酰氯的工业品中常含有少量硫酸,请你设计实验验证其中含有硫酸(写出实验方案及相关实验现象,不必写出具体实验操作________。可选试剂:稀盐酸、稀硫酸、BaCl2溶液、蒸馏水、石蕊试液)。
查看答案和解析>>
科目: 来源: 题型:
【题目】应用DHP作保护基合成梨小食心虫性外激素(H) 的路线如下:

己知:①DHP(![]() ) 的保护和脱保护机理为
) 的保护和脱保护机理为
②R-C≡CNa+R1Br→R-C≡C-R1+NaBr
③R-C≡CNa+ R1OH→R-C≡CH+R1ONa
(1)A的化学名称为________。
(2)F-G的反应类型________;G-H 的反应类型________。
(3)F的结构简式为_________ 。
(4)写出C→E 的化学方程式________ 。
(5)DHP的同分异构体中,能同时满足下列条件的共有______种(不考虑立体异构)
①链状结构 ②能发生银镜反应 ③分子中只有一个甲基。
写出其中核磁共振氢谱显示4组峰,且峰面积之比为3 :2:2: 1的所有分子结构简式:_______。
(6)写出用 和CH3C≡CNa 制备
和CH3C≡CNa 制备 的合成路线(其它试剂任选) ____。
的合成路线(其它试剂任选) ____。
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表,请回答:
实验编号 | HA物质的量浓度 | NaOH物质的量浓度 | 混合溶液的pH |
甲 | 0.2 | 0.2 | pH=a |
乙 | c | 0.2 | pH=7 |
丙 | 0.2 | 0.1 | pH>7 |
丁 | 0.1 | 0.1 | pH=9 |
(1)不考虑其它组的实验结果,单从甲组情况分析,如何用a (混合溶液的pH)来说明HA是强酸还是弱酸 .
(2)不考虑其它组的实验结果,单从乙组情况分析,C是否一定等于0.2(选填“是”或“否”).混合液中离子浓度c(A﹣)与 c(Na+)的大小关系是 .
(3)丙组实验结果分析,HA是酸(选填“强”或“弱”).该混合溶液中离子浓度由大到小的顺序是 .
(4)丁组实验所得混合溶液中由水电离出的c(OH﹣)=molL﹣1 . 写出该混合溶液中下列算式的精确结果(不需做近似计算).c(Na+)﹣c(A﹣)=molL﹣1 c(OH﹣)﹣c(HA)=molL﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于SO2的叙述正确的是( )
A.SO2是无色无味有毒的气体B.SO2有毒,不能做食品添加剂
C.SO2不溶于水D.SO2与NaOH反应能生成Na2SO3
查看答案和解析>>
科目: 来源: 题型:
【题目】1838年李比希提出了“基团”的定义,从此,有机化学中“基团”概念就确定了,下列有机基团的表达式不正确的是( )
A. 甲基-CH3 B.羟基-OH- C. 醛基-CHO D.羧基-COOH
查看答案和解析>>
科目: 来源: 题型:
【题目】Al、Fe、Cu 是重要的材料元素,在生产生活中有着广泛的应用。回答下列问题:
(1)基态Fe2+的核外电子排布式为[Ar]______,有__个未成对电子。
(2)氯化铝熔点为194℃,而氧化铝熔点为2050℃,二者熔点相差很大的原因是_____。
(3)已知Al 的第一电离能为578kJ/mol、第二电离能为1817 kJ/mol、第三电离能为2745 kJ/mol、第四电离能为11575 kJ/mol。请解释其第二电离能增幅较大的原因________。
(4)甲醇重整制氢反应中,铜基催化剂如CuO/SiO2具有重整温度低、催化选择性高的优点。Cu、Si、O元素电负性由大到小的顺序是____;SiO2中Si原子采取____杂化。
(5)一种铜的溴化物晶胞结构如图所示:该晶胞中铜的配位数是___,与溴紧邻的溴原子数目是________,由图中P点和Q点的原子坐标参数可确定R点的原子坐标参数为________;已知晶胞参数为apm,其密度为_______g/cm3 (列出计算式即可)。

查看答案和解析>>
科目: 来源: 题型:
【题目】研究NO2、NO、SO2 、CO等大气污染气体的处理具有重要意义。
(1)已知: CO可将部分氮的氧化物还原为N2。
反应I :2CO(g)+2NO(g) ![]() N2(g)+2CO2(g) △H=-746kJ.mol-1
N2(g)+2CO2(g) △H=-746kJ.mol-1
反应II :4CO(g)+2NO2(g) ![]() N2(g)+4CO2(g) △H=-1200kJ.mol-1
N2(g)+4CO2(g) △H=-1200kJ.mol-1
则反应NO2(g)+CO(g) ![]() CO2(g)+NO(g)的△H=______kJ/mol。
CO2(g)+NO(g)的△H=______kJ/mol。
(2)一定条件下,将NO2与CO以体积比1:2置于密闭容器中发生反应II,下列能说明反应达到平衡状态的是________。
a.体系压强保持不变 b.容器中气体密度保持不变
c.混合气体颜色保持不变 d.每消耗2molNO2的同时生成1molN2
(3)温度为T、容积为10L的恒容密闭容器中,充入1molCO和0.5 mol SO2发生反应:2CO(g)+SO2(g)![]() 2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:
2CO2(g)+S(g) 实验测得生成的CO2体积分数(φ) 随着时间的变化曲线如图所示:

①达到平衡状态时,SO2的转化率为__,该温度下反应的平衡常数K=______。
②其它条件保持不变,再向上述平衡体系中充入SO2(g).CO(g)、S(g)、CO2(g)各0.2mol,此时v(正)___v(逆) (填“>”“<”或“=”)。
(4)SCR法是工业上消除氦氧化物的常用方法,反应原理为4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:
4N2(g)+6H2O(g) △H<0.在催化剂作用下,NO转化率与温度的关系如图所示:

图中A点处NO的转化率_______(填“可能是”、“一定是 ”或“一定不是”)该温度下的平衡转化率;B点之后,NO转化率降低的原因可能是________。
A.平衡常数变大 B.副反应增多
C.催化剂活性降低 D.反应活化能增大
(5)2SO2(g)+O2(g) ![]() 2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。
2SO3(g) △H=-198kJ.mol-l 是制备硫酸的重要反应。在VL恒容密闭容器中充入2molSO2和1molO2,在不同条件下进行反应,反应体系总压强随时间的变化如图所示。a和b平衡时,SO3体积分数较大的是_______; 判断的依据是________。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com