
科目: 来源: 题型:
【题目】草酸(俗名乙二酸,分子式为H2C2O4)存在于自然界的植物中。草酸的钠盐和钾盐易溶于水,而其钙盐难溶于水。草酸晶体(H2C2O42H2O)无色,熔点101℃,易溶于水,受热脱水、升华,170℃ 以上分解.回答下列问题:

(1)甲组同学按照如图所示的装置,通过实验检验草酸晶体的分解产物,装置C中可观察到的现象是____________________________,由此可知草酸晶体分解的产物中有__________,装置B的主要作用是______________________________________________。
(2)乙组同学认为草酸晶体分解的产物中含有CO,为进行验证,选用甲组实验中的装置A、B和如图所示的部分装置(可以重复选用)进行实验.

乙组同学的实验装置中,依次连接的合理顺序为A、B、____________________。装置H反应管中盛有的物质是_______。能证明草酸晶体分解产物中有CO的现象是____________________________。
(3)设计实验证明:草酸的酸性比碳酸的强_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D是原子序数依次递增的前四周期元素,A元素的正化合价与负化合价的代数和为零;B元素原子的价电子结构为nsnnpn;C元素基态原子s能级的电子总数比p能级的电子总数多1;D元素原子的M能层全满,最外层只有一个电子。请回答:
(1)A元素的单质为A2,不能形成A3或A4,这体现了共价键的___性;B元素单质的一种空间网状结构的晶体熔点>3550℃,该单质的晶体类型属于________;基态D原子共有___种不同运动状态的电子。
(2)A与C形成的最简单分子的中心原子杂化方式是___________,该分子与D2+、H2O以2:1:2的配比结合形成的配离子是_________(填化学式),此配离子中的两种配体的不同之处为_____(填标号)。
①中心原子的价层电子对数 ②中心原子的孤电子对的对数 ③中心原子的化学键类型 ④VSEPR模型
(3)1molBC—中含有的π键数目为______;写出与BC-互为等电子体的分子和离子各一种______、______。
(4)D2+的硫酸盐晶体的熔点比D2+的硝酸盐晶体的熔点高,其原因是______。
(5)D3C具有良好的电学和光学性能,其晶体的晶胞结构如图所示,D+和C3—半径分别为apm、bpm,D+和C3—都是紧密接触的刚性小球,则C3—的配位数为_____,晶体的密度为____g·cm-3。

查看答案和解析>>
科目: 来源: 题型:
【题目】天然气是一种很重要的清洁能源,其主要成分为CH4 ,下列说法正确的是
A. 常温常压下CH4是液体 B. 一氯甲烷分子式为CH4Cl
C. CH4与Cl2可以发生加成反应 D. CH4完全燃烧生成CO2和H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】正丁醛是一种化工原料。某实验小组利用如图装置合成正丁醛.发生的反应如下:![]() 。
。

反应物和产物的相关数据列表如下:
沸点/℃ | 密度/(gcm-3) | 水中溶解性 | |
正丁醇 | 117.2 | 0.8109 | 微溶 |
正丁醛 | 75.7 | 0.8017 | 微溶 |
已知:醛基可被酸性Na2Cr2O7氧化。
实验步骤如下:
将6.0gNa2Cr2O7放入100mL烧杯中,加水30mL溶解,再缓慢加入5mL浓硫酸,将所得溶液小心转移至B中。在A中加入4.0g正丁醇和几粒沸石,加热。当有蒸汽出现时,开始滴加B中溶液。滴加过程中保持反应温度为90~95℃,在E中收集90℃以上的馏分。将馏出物倒入分液漏斗中,分去水层,有机层干燥后蒸馏,收集75~77℃馏分,产量2.0g。回答下列问题:
(1)实验中,能否将Na2Cr2O7溶液加到浓硫酸中,说明理由__________________。
(2)加入沸石的作用是______________,若加热后发现未加入沸石,应采取的正确措施是______________________________。
(3)上述装置图中,B仪器的名称是_____________,D仪器的名称是_______________。
(4)反应温度应保持在90~95℃,其原因是___________________________。
(5)温度计C1的作用_________________,C2的作用_______________。
(6)本实验中,正丁醛的产率为_________%。
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合题图的是( ) 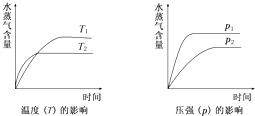
A.CO2(g)+2NH3(g)CO(NH2)2(s)+H2O(g);△H<0
B.CO2(g)+H2(g)CO(g)+H2O(g);△H>0
C.CH3CH20H(g)CH2=CH2(g)+H2O(g);△H>0
D.2C6H5CH2CH3(g)+O2(g)2C6H5CH=CH2(g)+2H2O(g);△H<0
查看答案和解析>>
科目: 来源: 题型:
【题目】温度700℃时,向容积为1L的密闭容器中充入一定量的CO和H2O发生反应CO(g)+H2O(g)CO2(g)+H2(g),反应过程中测定的部分数据见表(表中t1<t2).下列说法正确的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol |
0 | 0.60 | 0.30 |
t1 | 0.40 | |
t2 | 0.10 |
A.反应在t1min内的平均速率为v(H2)=0.20/t1molL﹣1min﹣1
B.保持其他条件不变,向平衡体系中再通入0.10molH2O,与原平衡相比,达到新平衡时CO转化率增大,H2O的体积分数减小
C.温度升至800℃,上述反应平衡常数为0.64,则正反应为吸热反应
D.700℃时,若向密闭容器中充入CO(g)、H2O(g)、CO2(g)、H2(g)的物质的量分别为0.60mol、1.00mol、0.60mol、0.60mol,则此时该反应v(正)<v(逆)
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) ![]() CH3OH(g) △H=-116kJ/mol
CH3OH(g) △H=-116kJ/mol
(1)已知:CO和H2的燃烧热分别为283kJ/mol、286kJ/mol 。1mol甲醇气体完全燃烧生成CO2和液态水的热化学方程式为_________________________________。
(2)下列措施中有利于提高2H2(g)+CO(g)![]() CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
A.分离出CH3OH B.升高温度 C.增大压强 D.加入合适的催化剂
(3)在容积为2L的恒容容器中,分别在230℃、250℃、270℃下,改变H2和CO的起始组成比[(n(H2)/n(CO)],起始时CO的物质的量固定为1mol,实验结果如图所示:
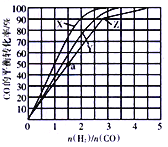
①Z曲线对应的温度是__________,判断的依据是________________。
②从图中可以得出的结论是(写两条)____________________、______________________。
(4)利用图中a点对应的数据,计算曲线Z对应温度下反应2H2(g)+CO(g)![]() CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH和0.5molH2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10﹣6 , CaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是( ) 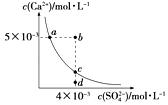
A.CaSO4在稀硫酸中的溶解性比在纯水中的溶解性强
B.a点对应的Ksp等于c点对应的Ksp
C.d点溶液通过蒸发可以变到c点
D.b点将有沉淀生成,平衡后溶液中c(SO42﹣)一定等于3×10﹣3mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com