
科目: 来源: 题型:
【题目】有机合成中的一种重要还原剂—铝氢化钠(NaAlH4),其合成线路如图所示:

(1)已知:AlCl3的熔点为190℃,沸点为178℃,在潮湿空气中会水解。某实验小组利用图所示装置制取无水AlCl3。
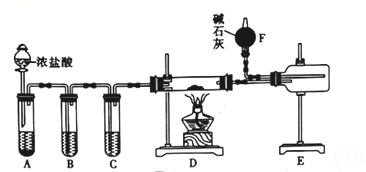
①A中所盛装的固体试剂的化学式为________________________。
②装置F的作用是_________________________________________________。
(2)若改变A、B、D 中的试剂就可以用该装置制取NaH,如制取中操作不当,制得的NaH中可能含有的主要杂质为__________(填序号)。
a.Na b.NaOH c.Na2O2 d.Na2CO3
(3)AlCl3与NaH 反应时,需将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末上,此反应中NaH的转化率较低的原因是____________________________________。
(4)铝氢化钠遇水发生剧烈反应,甚至爆炸,其反应的化学方程式为__________________________。
(5)现设计如图所示四种装置,测定铝氢化钠粗产品的纯度(只含NaH杂质)。
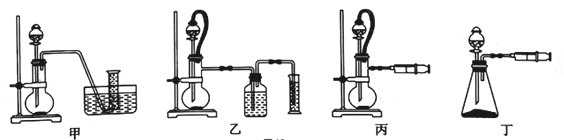
从简约性、安全性和准确性考虑,最适宜的装置是_________(填编号)。铝氢化钠与水完全反应,读气体体积时需冷却至室温,则冷却至室温的标志是__________________________________。
若称取24.0g样品与水完全反应后,测得生成气体在标准状况下的体积为38.08L,则样品中铝氢化钠的质量分数为_______________。(结果保留两位有效数字)。
查看答案和解析>>
科目: 来源: 题型:
【题目】在四个不同容器中,不同条件下进行合成氨反应。根据在相同时间内测定的结果判断生成氨的速率最快的是
A. V(H2)=3 mol·L-1·min-1B. V(N2)=2mol·L-1·min-1
C. V(NH3)=2mol·L-1·min-1D. V(H2)=5mol·L-1· h-1
查看答案和解析>>
科目: 来源: 题型:
【题目】有关 ![]() 分子结构的下列叙述中正确的是( ) ①除苯环外的其余碳原子有可能都在一条直线上
分子结构的下列叙述中正确的是( ) ①除苯环外的其余碳原子有可能都在一条直线上
②除苯环外的其余碳原子不可能都在一条直线上
③12个碳原子不可能都在同一平面上
④12个碳原子有可能都在同一平面上.
A.①②
B.②③
C.①③
D.②④
查看答案和解析>>
科目: 来源: 题型:
【题目】为了除去粗盐中的Ca2+、SO42-及泥沙,可将粗盐溶于水,然后进行下列操作:①过滤;②加适量的盐酸;③加过量的Na2CO3溶液;④加过量BaCl2溶液,正确的操作顺序是( )
A.①③④②B.③①④②C.①②③④D.④③①②
查看答案和解析>>
科目: 来源: 题型:
【题目】乙炔和乙烯都是基本的重要有机化工原料。由它们和常见的有机物可合成一种醚类香料和制备聚乙烯醇缩丁醛。具体合成路线如图所示(部分反应条件和产物略去):
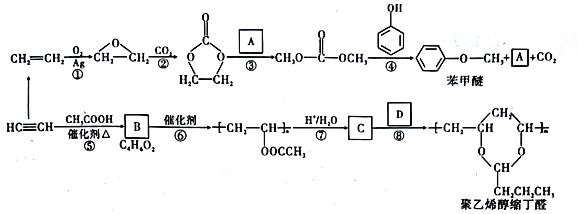
已知以下信息:
![]() 。
。
回答下列问题:
(1)A的名称是_________________,D中含有的官能团名称是________________________。
(2)B的结构简式为__________________。聚乙烯醇缩丁醛的分子式为_________________________。
(3)⑦的反应类型是__________________________。
(4)写出反应③的化学方程式:_____________________________________。
(5)M 与碳酸二甲酯(![]() )互为同系物,满足下列条件的M 的同分异构体共有______种。其中核磁共振氢谱有3组峰,峰面积之比为3 :2 :3,该同分异构体的结构简式为________________。
)互为同系物,满足下列条件的M 的同分异构体共有______种。其中核磁共振氢谱有3组峰,峰面积之比为3 :2 :3,该同分异构体的结构简式为________________。
①相对分子质量比碳酸二甲酯多14;
②酸性条件下能发生水解,且水解后的产物不含 结构;
结构;
③分子中不含醚键结构(![]() )。
)。
(6)参照上述合成路线,设计一条由2-氯丁烷和必要的无机试剂制备 的合成路线(注明必要的反应条件)。___________________
的合成路线(注明必要的反应条件)。___________________
查看答案和解析>>
科目: 来源: 题型:
【题目】有色金属行业发展蕴藏着巨大潜力。目前,全世界消费量排在前五位的为铜、铝、铅、锌、镍。回答下列问题。
(1)铜原子的电子占有________种能量不同的原子轨道;在元素周期表中铝和铅元素处于周期表的_____区。
(2)配合物分子内(如图)的化学键有____________(填序号)。
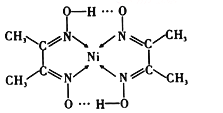
A.氢键 B.离子键 C.共价键 D.金属键 E.配位键
(3)很多不饱和有机物在Ni催化下可以与H2发生加成反应。如①CH2=CH2、②CH![]() CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有___________(填物质序号);预测σ键与π键比值为3∶1的分子的立体结构为_______________形。
CH、③苯、④HCHO等,其中分子中C原子为sp杂化的有___________(填物质序号);预测σ键与π键比值为3∶1的分子的立体结构为_______________形。
(4)硫酸锌是最重要的锌盐,为无色斜方晶体或白色粉末,其七水合物(ZnSO4·7H2O) 俗称皓矾,是一种天然矿物。请在SO42-的立体结构图(如图)中,描画出氧原子(用实心圆点“![]() ”表示)和硫原子(用空心圆点“O”表示)的位置。_____________
”表示)和硫原子(用空心圆点“O”表示)的位置。_____________
(5)氢气是新型清洁能源,镧(La)和镍(Ni)的合金可做储氢材料。
①下列关于该贮氢材料及氢气的说法,正确的是__________(填序号)。
A.该材料中镧原子和镍原子之间存在化学键,是原子晶体
B.已知镧和镍的第一电离能分别为5.58eV、7.64eV,可见气态镧原子比气态镍原子更容易变成+1价的气态阳离子
C.氢分子被吸收时首先要在合金表面解离变成氢原子,同时放出热量
D.该材料贮氢时采用常温高压比采用常温常压更好
E.氢气很难液化是因为虽然其分子内氢键很强,但其分子间作用力很弱
②该合金的晶胞如图所示,属六方晶系,底面夹角为60°(120°),经测定晶胞参数a=511pm,c=397pm,晶胞中心有一个镍原子,其他镍原子都在晶胞面上,镧原子都在晶胞顶点上,该晶体的化学式为_______________。若每个晶胞可吸收3个H2,则储氢后(氢进入晶胞空隙,体积不变)该晶胞的密度计算式为___________________________。(NA表示阿伏加德罗常数)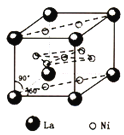
查看答案和解析>>
科目: 来源: 题型:
【题目】高铁酸钾是一种高效的多功能水处理剂,具有强氧化性。制备高铁酸钾方法很多。
(1)干法制备高铁酸钾。将Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物。此制备反应中,氧化剂与还原剂的物质的量之比为_____________________。
(2)湿法制备高铁酸钾。工业上常采用NaClO氧化法生产,原理如下:
a.3NaClO+2Fe(NO3)3+ 10NaOH=2Na2FeO4↓+3NaCl+6NaNO3+5H2O
b.Na2FeO4+2KOH =K2FeO4+2NaOH
主要的生产流程如图:
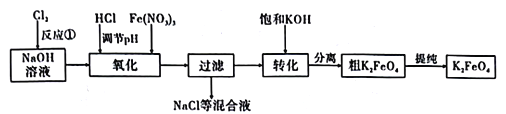
①流程图中“转化”是在某低温下进行的,说明此温度下的溶解度S(K2FeO4)_____S(Na2FeO4)(填“>”“<”或“=”)。
②湿法制备中,反应的温度、原料的浓度和配比对高铁酸钾的产率都有影响。如图,图甲为不同的温度下,不同质量浓度的Fe(NO3)3对K2FeO4生成率的影响;图乙为一定温度下,Fe(NO3)3质量浓度最佳时,NaClO浓度对K2FeO4生成率的影响。工业生产中最佳温度为_________℃,此时Fe(NO3)3与NaClO 两种溶液最佳质量浓度之比为______________。

③若NaClO加入过量,氧化过程中会生成Fe(OH)3,写出该反应的离子方程式:_____________________。若Fe( NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,此反应的离子方程式为__________________________________。
(3)K2FeO4在水溶液中易水解:4FeO42-+10H2O![]() 4Fe(OH)3+8OH-+3O2↑。
4Fe(OH)3+8OH-+3O2↑。
①在“提纯”K2FeO4中采用重结晶、洗涤、低温烘干的方法,则洗涤剂最好选用__________溶液(填序号)。
A.H2O B.CH3COOK、异丙醇 C.NH4Cl、异丙醇 D.Fe(NO3)3、异丙醇
②K2FeO4在处理水的过程中所起的作用有_______________________。
(4)室温下,向含有Fe3+的CuSO4溶液中加入Cu(OH)2可使Fe3+转化为Fe(O H)3沉淀,从而除去Fe3+。该反应的平衡常数为_____________________。(已知常温下的溶度积常数:Ksp[Cu(OH)2]=2.0×10-20, Ksp[Fe(OH)3]=4.0×10-38)。
查看答案和解析>>
科目: 来源: 题型:
【题目】《巴黎协定》所倡导的是全球绿色、低碳。如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。二氧化碳的捕集、利用是我国能源领域的一个重要战略方向。
(1)科学家提出由CO2制取C的太阳能工艺如图14 甲所示,总反应的化学方程式为_________________________________。
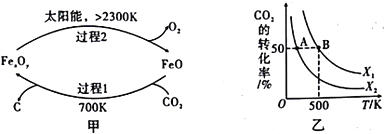
(2)CO2经催化加氢可合成低碳烯烃,合成乙烯的反应为2CO2(g)+6H2(g)=C2H4(g)+4H2O(g) ΔH。
向1L恒容密闭容器中充入2mol CO2(g)和n mol H2(g),在一定条件下发生该反应。CO2的转化率与温
度、投料比[x=![]() ]的关系如图乙所示。
]的关系如图乙所示。
①该反应的ΔH__________0(填“>”、“<”或“=”)。
②为提高CO2的平衡转化率,除改变温度外,还可采取的措施是____________(写1条即可)。
③图中X1_________X2(填“<”“>”.或“=”,下同)。
④若图乙中B点的投料比为2,则500℃时的平衡常数K(B)=_________________。
(3)工业上用CO2生产甲醇燃料,进一步可合成二甲醚。已知:298K和101kPa条件下,
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(l) △H=-akJmol-1
CH3OH(g)+H2O(l) △H=-akJmol-1
2H2(g)+O2(g)=2H2O(l) △H=-bkJmol-1
CH3OH(g)=CH3OH(l) △H=-ckJmol-1
①CH3OH(l)燃烧热的热化学方程式为________________________________。
②合成二甲醚的总反应为2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) △H=-130.8kJmol-1。一定条件下,该反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____________(填序号)。
CH3OCH3(g)+3H2O(g) △H=-130.8kJmol-1。一定条件下,该反应达到平衡状态后,若改变反应的某一个条件,下列变化能说明平衡一定向正反应方向移动的是_____________(填序号)。
a.逆反应速率先增大后减小 b.H2的转化率增大 c.反应物的体积百分含量减小
③在某压强下,合成二甲醚的反应在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6molCO2和12mol H2充入2L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____________;KC、KD、KE三者之间的大小关系为___________________。
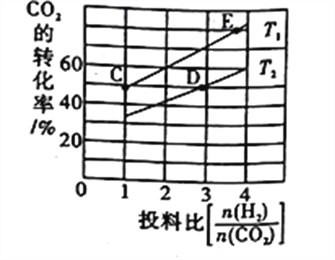
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com