
科目: 来源: 题型:
【题目】能源短缺是人类社会面临的重大问题.甲醇是一种可再生能源,具有广泛的开发和应用前景.
(1)工业上一般采用下列两种反应合成甲醇: 反应I:CO(g)+2H2(g)CH3OH(g)△H1
反应II:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H2
①上述反应符合“原子经济”原则的是(填“I”或“Ⅱ”).
②下表所列数据是反应I在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断△H10 (填“>”、“=”或“<”).
③某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CH3OH)=0.8mol/L,则CO的转化率为 , 此时的温度为(从上表中选择).
④恒温、恒容时,下列情况不能说明反应I已经达到化学平衡状态的是 .
a、容器各物质的浓度保持不变; b、容器内压强保持不变;
c、υ(CO)消耗═1/2υ(H2)生成 d、容器内的密度保持不变
(2)25℃、101kPa时,燃烧16g液体甲醇生成CO2和H2O(l),放出的热量为363.26kJ,写出甲醇燃烧的热化学方程式: .
(3)某实验小组依据甲醇燃烧的反应原理,设计一个燃料电池电解Na2SO4溶液(图如下).请根据图示回答下列问题: 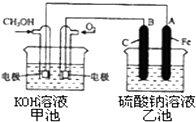
①通入甲醇蒸气的电极应为极(填写“正”或“负”),该电极上发生的电极反应是(填字母代号).
a.2CH3OH﹣12e﹣+3O2═2CO2+4H2O
b.CH3 OH﹣6e﹣+8OH﹣═CO32﹣+6H2O
c.O2+2H2O+4e﹣═4OH﹣
d.O2﹣4e﹣+4H+═2H2O
②写出电极A的名称 . 写出B电极的电极反应式 .
③当碱性甲醇燃料电池消耗3.36L 氧气时(折合为标准状况),理论上电解Na2SO4溶液生成气体的总物质的量是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】乙烯的产量可以用来衡量一个国家的石油化工发展水平.请回答:
(1)乙烯的结构式是 ______ 。
(2)若将乙烯气体通入溴的四氯化碳溶液中,反应的化学方程式为 ______ 。
(3)可以用来除去乙烷中混有的乙烯的试剂是 ______ 。(填序号)
①水②氢气③溴水④酸性高锰酸钾溶液
(4)在一定条件下,乙烯能与水反应生成有机物A,其反应方程式为 ______ ,其反应类型是 ______ 反应(填“取代”或“加成”) 。
查看答案和解析>>
科目: 来源: 题型:
【题目】到目前为止,由化学能转变的热能或电能仍然是人类使用的最主要的能源.
(1)化学反应中放出的热能(焓变,△H)与反应物和生成物的键能(E)有关. 已知:H2(g)+Cl2(g)═2HCl(g)△H=﹣185kJ/mol
E(H﹣H)=436kJ/mol,E(Cl﹣Cl)=243kJ/mol
则E(H﹣Cl)= .
(2)纳米级Cu2O由于具有优良的催化性能而受到关注.已知: 2Cu(s)+ ![]() O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
O2(g)═Cu2O(s)△H=﹣169kJmol﹣1 ,
C(s)+ ![]() O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
O2(g)═CO(g)△H=﹣110.5kJmol﹣1 ,
2Cu(s)+O2(g)═2CuO(s)△H=﹣314kJmol﹣1
则工业上用炭粉在高温条件下还原CuO制取Cu2O和CO的热化学方程式为 .
(3)如图是N2和H2反应生成2mol NH3过程中能量变化示意图,请计算每生成1mol NH3放出热量为 . 
查看答案和解析>>
科目: 来源: 题型:
【题目】有下列各组微粒或物质:
A、O2和O3
B、 ![]() 和
和 ![]()
C、CH3CH2CH2CH3和 ![]()
D、 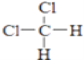 和
和 
E、CH3CH2CH2CH3和 ![]()
(1)________组两种微粒互为同位素;
(2)________组两种物质互为同素异形体;
(3)________组两种物质属于烃;
(4)________组两物质互为同分异构体;
(5)________组两物质是同一物质.
查看答案和解析>>
科目: 来源: 题型:
【题目】氢化钙(CaH2)固体是一种储氢材料,遇水反应生成氢氧化钙和氢气,是登山运动员常用的能源提供剂。某化学兴趣小组设计制取氢化钙的装置如下图所示( 固定装置已略去)。下列说法正确的是

A. 装置②③⑤中依次盛放的是浓硫酸、氢氧化钠溶液、浓硫酸
B. 为了节省药品,应先点燃④处酒精灯,后打开①中分液漏斗的活塞
C. 装置⑤中竖直导管的作用是平衡压强,观察H2流速以调节反应的进行
D. 实验完毕,取④中的固体与水反应有H2生成,证明固体中含有CaH2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A.凡是放热反应都是自发的,因为吸热反应都是非自发的
B.任何情况下,温度都不可能对反应的方向起决定性作用
C.焓变与熵变是判断反应方向的两个主要因素
D.自发反应在任何条件下都能实现
查看答案和解析>>
科目: 来源: 题型:
【题目】可逆反应A(g)+3B(g)![]() 2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
2C(g)+2D(g) 在4种不同情况下反应速率分别如下,其中反应速率v最大的是
A. v(A)=0.15mol/(L·min) B. v (B)=0.6 mol/(L·min)
C. v (C)=0.3 mol/(L·min) D. v (D)=0.1 mol/(L·min)
查看答案和解析>>
科目: 来源: 题型:
【题目】电解原理在化学工业中有广泛应用.下图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连. 
请回答以下问题:
(1)若X、Y都是惰性电极,a是饱和KCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,Y电极反应式是、发生反应.在X极附近观察到的现象是电极反应式是检验Y电极反应产物的方法是
(2)若X、Y都是银电极,a是稀硝酸银溶液,开始实验,X极的电极反应式是 . Y电极的电极反应式是 , 电解前后硝酸银溶液的浓度(变大、变小或不变)若某电极质量增重108克,则在电路中有mol的电子发生转移.
查看答案和解析>>
科目: 来源: 题型:
【题目】以工业制立德粉后的铅锌废渣(主要成分为ZnO和PbSO4,杂质含Si、Fe、Cu、Cd等元素)为原料,可以制活性氧化锌和黄色颜料铅铬黄,工业流程如图所示:

已知:Ksp(PbSO4)=1.6×10-8,Ksp(PbCO3)= 7.4×10-14
(1)“碱浸”过程中PbSO4发生反应的离子方程式为_________________________,气体A 的化学式为____________________。
(2)“酸浸”过程中pH不宜过低,若pH过低,可能出现的问题是___________________________。
(3)“沉降I”过程中发生反应的离子方程式为_____________________________________。
(4)滤液D中溶质的主要成分为_____________,为制得较为纯净的ZnO,“煅烧”之前应该进行的操作I是_____________________________。
(5)以1t含锌元素10%的铅锌废渣为原料,制得活性氧化锌113.4kg,依据以上数据_______(填“能”或“不能”)计算出锌元素的回收率。若能,写出计算结果,若不能,请说明理由________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com