
科目: 来源: 题型:
【题目】W、X、Y、Z是四种常见的短周期主族元素,其原子半径随原子序数的变化如图所示。

已知Y、Z两种元素的单质是空气的主要成分,W原子的最外层电子数与Ne原子的最外层电子数相差1。请回答下列问题:
(1)写出四种元素的元素符号:W________;X________;Y________;Z________。
(2)四种元素的所有化合价中,最低负化合价为________价,最高正化合价为________价。
(3)甲和乙分别是由W、X、Y、Z四种元素中的三种元素组成的常见化合物,化合物甲具有消毒杀菌作用,其化学式为________;化合物乙是一种常见的化肥,其化学式为________。
(4)HYO3的酸性比HWO强,有人据此认为Y的非金属性强于W,你认为这种看法是否正确,说明理由:________ 。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲、乙、丙、丁、戊都是单质,其中甲、乙、丙是常见金属,丁和戊是气体,且丁呈黄绿色.A~K是化合物.F是红褐色沉淀,G是淡黄色固体粉末,D的溶液是蓝色的,K是丁的气态氢化物.已知乙和丙在周期表中位于同一周期,且丙原子最外能层电子构型为ns1 . 它们之间有如图的转化关系(部分反应物或产物省略). 
回答以下问题:
(1)G的电子式:
(2)甲基态原子的电子排布式为 , 与同周期的金属元素相比,第一电离能由小到大的顺序是(用元素符号表示).
(3)反应②的离子方程式: .
(4)乙的高价阳离子的最高能级电子排布图为: . 检验该离子常用KSCN溶液.丙的外围电子排布式为 , 在元素周期表中的位置为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是( )
A. 用氨水可以鉴别Al3+、Mg2+和Ag+
B. 用水鉴别乙醇、乙酸乙酯和溴苯
C. 除去乙酸乙酯中的乙酸:用NaOH溶液,然后分液
D. 除去乙烷中少量的乙烯:光照下通入Cl2,生成液态CH2Cl-CH2Cl,气液分离
查看答案和解析>>
科目: 来源: 题型:
【题目】分类是化学学习与研究的常用方法,下列分类正确的是( )
A. 混合物:水玻璃、氯水、福尔马林、聚乙烯
B. CO2、NO2、P2O5均为酸性氧化物,Na2O、Na2O2均为碱性氧化物
C. 根据能否发生丁达尔效应,将分散系分为溶液、胶体和浊液
D. 根据溶液导电能力强弱,将电解质分为强电解质和弱电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】已知化学平衡、电离平衡、水解平衡和溶解平衡均符合勒夏特列原理.请回答下列问题:
(1)常温下,浓度均为0.1molL﹣1的下列六种溶液的pH如下表:
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
①上述盐溶液中的阴离子,结合质子能力最强的是 .
②根据表中数据判断,浓度均为0.01molL﹣1的下列四种物质的溶液中,酸性最强的是;将各溶液分别稀释100倍,pH变化最小的是(填编号).
A.HCN B.HClO C.H2CO3 D.CH3COOH
③据上表数据,请你判断下列反应不能成立的是(填编号).
A.CH3COOH+Na2CO3═NaHCO3+CH3COONa
B.CH3COOH+NaCN═CH3COONa+HCN
C.CO2+H2O+2NaClO═Na2CO3+2HClO
④要增大氯水中HClO的浓度,可向氯水中加入少量的碳酸钠溶液,反应的离子方程式为 .
(2)已知常温下Cu(OH)2的Ksp=2×10﹣20 . 又知常温下某CuSO4溶液里c(Cu2+)=0.02molL﹣1 , 如果要生成Cu(OH)2沉淀,则应调整溶液pH大于;要使0.2molL﹣1的CuSO4溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一)则应向溶液里加NaOH溶液,使溶液pH为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各组中均为微量元素的是 ( )
A. Fe Mn Zn Mg B. Zn Cu Mn Ca
C. Zn Cu B Fe D. Mg Mn Cu Mo
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示,A、F为石墨电极,B、E为铁片电极.按要求回答下列问题. 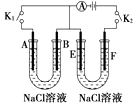
(1)打开K2 , 合并K1 . B为极,A的电极反应为 .
(2)打开K1 , 合并K2 . E为极,F极的电极反应为 , 检验F极产生气体的方法是 .
(3)若往U型管中滴加酚酞,进行(1)(2)操作时,A、B、E、F电极周围能变红的是 , 原因是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】亚硫酸盐是一种常见食品添加剂.为检验某食品中亚硫酸盐含量(通常以1kg样品中含SO2的质量计),某研究小组用“碘氧化还原滴定法”进行测定,实验流程如图: 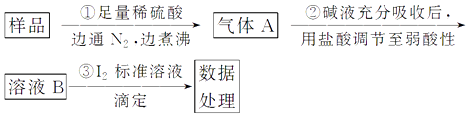
(1)碘标准液应选用(填“酸式”或“碱式”)滴定管盛装,加注标准液之前必须对滴定管进行、洗涤、润洗.
(2)锥形瓶内的指示剂为 , 判断达到滴定终点的依据 .
(3)下列操作会使测定结果偏大的有
A.起始读数时平视,终点读数时俯视
B.未用标准液润洗滴定管
C.步骤①中用稀盐酸代替稀硫酸
(4)若取样品wg,按乙方案测得消耗0.010molL﹣1I2溶液VmL,则1kg样品中含SO2的质量是g(用含w、V的代数式表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】钠是一种非常活泼的金属元素,其单质及化合物在科研、生产中起着重要作用.
(1)利用金属钠和CO2反应可制备金刚石,其相关反应的热化学方程式如下: 4Na(g)+3CO2(g)═2Na2CO3(l)+C(s,金刚石)△H=a kJmol﹣1
CO2(g)+4Na(g)═2Na2O(s)+C(s,金刚石)△H=b kJmol﹣1
反应6Na2O(s)+2C(s,金刚石)═8Na(g)+2Na2CO3(l)的△H=kJmol﹣1(用含a、b的代数式表示).
(2)T℃时,体积为2L的恒容容器中加入一定量的Na2SO4固体和氢气,发生如下反应: Na2SO4(s)+4H2(g)Na2S(s)+4H2O(g).
①若降低温度,K值减小,则反应的△H0(填“>或“<”).
②下列说法错误的是 .
A.增加Na2SO4(s)的量可加快反应速率
B.当混合气体的密度一定时,该反应达到平衡状态
C.保持温度不变,向平衡体系中再通入一定量的H2 , △H不变
D.其他条件不变,升高温度,则v(正)增大,v(逆)减小,平衡右移
③若2min内反应达到平衡,此时气体质量增加了8g,则用H2表示的反应速率为;已知反应过程中H2的体积分数与时间的关系如上图所示,则T℃下该反应的平衡常数为 .
④若反应达平衡后,加入一定量的H2 , 再次平衡后H2O的体积分数(填“增大”“减小”或“不变”).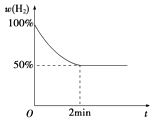
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com