
科目: 来源: 题型:
【题目】下列说法中正确的是
A.甲烷分子中只含有非极性键
B.乙烯只能加成、不能取代,苯只能取代、不能加成
C.常温下,苯是一种不溶于水且密度比水小的液体
D.CH3COOH和CH3CH2OH互为同系物
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上有一种用CO2来生产甲醇燃料的方法:CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1 , 将6mol CO2和8mol H2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).图中数据a(1,6)表示:在1min时H2的物质的量是6mol. 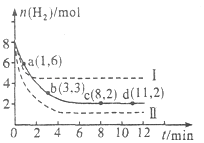
(1)a点正反应速率(填“大于”“等于”或“小于”)逆反应速率.
(2)下列时间段平均反应速率最大的是 .
A.O~1min
B.1~3min
C.3~8min
D.8~11min
(3)仅改变某一实验条件再进行两次实验测得H2的物质的量随时间变化如图中所示(虚线).曲线I对应的实验条件改变是 , 曲线Ⅱ对应的实验条件改变是 , 体积不变再充入3molCO2和4mol H2 , H2O(g)的体积分数(填“增大”“不变”或“减小”).
(4)若将1molCO2和3molH2充入该容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇脱氢可制取甲醛CH3OH(g)HCHO(g)+H2(g)△H,甲醇的平衡转化率随温度变化的曲线如图所示.下列有关说法正确的是( ) 
A.△H<0
B.从Y点到Z点可通过升高温度实现
C.从Y点到X点可通过使用催化剂实现
D.600 K时,Y点甲醇的v正<v逆
查看答案和解析>>
科目: 来源: 题型:
【题目】电池在我们的生活中有着重要的应用,请回答下列问题:
(1)为了验证Fe2+与Cu2+氧化性强弱,下列装置能达到实验目的的是______(填序号),写出正极的电极反应式_______。若构建原电池时两个电极的质量相等,当导线中通过0.05mol电子时,两个电极的质量差为________。

(2)将CH4设计成燃料电池,其利用率更高,装置如图所示(A、B为多孔碳棒)。

实验测得OH定问移向B电极,则_____(填“A”或“B”)处电极入口通甲烷,其电极反应式为___________。当消耗甲院的体积为33.6 L(标准状况下)时,假设电池的能量转化率为80%,则导线中转移电子的物质的量为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】A原子的L层比B原子L层少3个电子,B原子核外电子总数比A原子多5个,由此AB可形成( )
A.离子化合物B2A3B.离子化合物B3A2C.共价化合物B3A2D.共价化合物B2A3
查看答案和解析>>
科目: 来源: 题型:
【题目】小苏打是一种常用的食品添加剂。
(1)精制食盐是制备小苏打的原料之一。粗盐中含有少量Ca2+、Mg2+、SO42-,粗盐精制的步骤顺序是:溶解→ → → → (填字母编号)。_____________
a.加盐酸调pH b.加Ba(OH)2溶液 c.加Na2CO3溶液 d.过滤
(2)NH3、CO2先后通入饱和食盐水中,反应的离子方程式________________。
(3)侯氏制碱法中,母液的处理方法是通入氨气,再加入细小食盐颗粒,最后冷却析出的副产品是_______;简述通氨气的作用____________________________________。
(4)称取2.640 g小苏打样品(含少量NaCl),配置成250 mL溶液,准确取出20.00 mL溶液于锥形瓶中,滴加_______作指示剂,滴定时消耗0.1000 mol/L盐酸的体积为20.67 mL。则该样品中碳酸氢钠的质量分数为_________(保留两位小数)。若装标准溶液的滴定管没有润洗,则测得的结果会____(填“偏大”、“偏小”或“不变”)。
(5)测定上述样品中碳酸氢钠的质量分数还可通过如图装置进行测定。实验需使用的定量仪器是_____;写出涉及的化学方程式__________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是元素周期表的一部分,针对表中的①~⑨九种元素,填写下列空白:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
2 | ① | ② | ③ | |||||
3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
4 | ⑨ |
(1)在这些元素中,化学性质最不活泼的是______(填元素符号),②位于元素周期表的第____纵行。
(2)这些元素的最高价氧化物的水化物中,碱性最强的化合物的电子式是___________。
(3)④的单质比⑨的单质熔点_______(填“高”或“低”),④⑤⑥⑦的简单离子半径由小到大的顺序为___________________(用序号表示)。
(4)①与⑦形成的某种化合物经常用作萃取剂,其结构式为________,该化合物属于________(填“共价”或“离子”)化合物。④与③形成的淡黄色的固体的阴、阳离子的个数比为_______。
(5)元素③与元素⑥相比,能证明这两种元素非金属性强弱的事实是_______(填选项序号)。
A.常温下③的单质和⑥的单质状态不同 B.③的简单氢化物比⑥的简单氢化物稳定
C.简单氢化物的沸点:③>⑥ D.③的单质能与⑥的简单氢化物反应生成⑥的单质
查看答案和解析>>
科目: 来源: 题型:
【题目】I.氨是一种重要的工业原料。回答下列问题:
(1)催化剂存在下,NH3可用来消除NO的污染,生成两种对环境无害的物质。写出反应的化学方程式____________;该反应中氧化产物与还原产物的物质的量之比为____。
(2)当运输氨气的管道发生泄漏时,可用一种挥发性液体________(写试剂名称) 进行检查,出现的现象是___________________________________。
II.联氨(N2H4)具有较强的还原性。工业上用过量氨气和NaClO溶液来制备。
(1)制取NaClO所用的原料是_________、_________。解释氨气过量的原因_________。
常温下,向10mL pH=2的盐酸中滴加等浓度氨水。加入氨水的体积(V)与溶液pH的关系如图所示。

(2)a点溶液中由水电离产生的c(H+)___10-7mol/L (填>、<或=);用平衡移动原理解释b点溶液呈酸性的原因___________。
(3)比较c点溶液中所有离子浓度大小关系是_________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】a、b、c、d、e、f为六种原子序数依次增大前20号主族元素,a、b、c、d位于同周期,b、f位于同主族,其中a、b、f 为金属元素,c的最外层电子数是其次外层电子数的3倍,c与f 的原子序数和是e的2倍。下列说法错误的是
A. 原子半径a>b>c>d
B. 最简单气态氢化物的稳定性e<c<d
C. 最高价氧化物对应的水化物的碱性f>b
D. fc2、ec2两种化合物中c的化合价相同
查看答案和解析>>
科目: 来源: 题型:
【题目】I.羰基硫(COS)可作为熏蒸剂,分子结构与CO2相似。回答下列问题:
(1)碳原子的核外电子排布式为____________;组成羰基硫的元素中,半径最大的原子其核外有_____种不同能量的电子。
(2)羰基硫为___(填“极性”或“非极性”)分子,羰基硫的电子式为_____________。
(3)解释稳定性CO2大于CS2的原因________________________________________。
II.密闭容器中,发生反应:CO(g)+H2S(g)![]() COS(g)+H2(g)
COS(g)+H2(g)
(4)已知逆反应速率随时间变化如图所示,则t0时改变的条件可能是_____________或________________。

(5)该反应达到平衡后,其他条件不变,升高温度,H2S浓度增加,表明该反应是___(填“放”或“吸”)热反应,平衡常数K将____(填“增大”、“减小”或“不变”);若在反应体系中通入一定量SO2(g),判断平衡移动的方向并解释原因。 ________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com