
科目: 来源: 题型:
【题目】下列说法正确的是
A.非金属原子间不可能形成离子键;
B.不同原子形成的化学键一定是极性键;
C.共价化合物中不可能含离子键;
D.离子化合物中不可能含有共价键。
查看答案和解析>>
科目: 来源: 题型:
【题目】向MgSO4和Al2(SO4)3的混合溶液中,逐滴加入NaOH溶液.下列图象中,能正确表示上述反应的是(横坐标表示加入NaOH溶液的体积,纵坐标表示反应生成沉淀的质量)( )
A.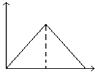
B.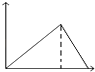
C.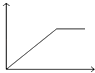
D.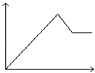
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述错误的是
A.通常情况下,甲烷跟强酸、强碱、强氧化剂不起反应
B.甲烷是正四面体结构
C.甲烷跟氯气反应无论生成CH3Cl、CH2Cl2、CHCl3,还是CCl4,都属于取代反应
D.甲烷的四种取代物常温下均为液体
查看答案和解析>>
科目: 来源: 题型:
【题目】如图所示(乙装置中X为阳离子交换膜,甲醚的结构简式为CH3OCH3) 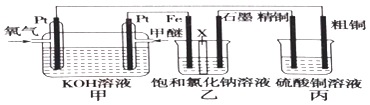
根据要求回答下列相关问题:
(1)写出负极的电极反应: .
(2)氢氧化钠主要在(填“铁极”或“石墨极”)区生成.
(3)如果粗铜中含有锌、银等杂质,则粗铜的电极反应为:、 .
(4)反应一段时间,硫酸铜溶液的浓度将(填“增大”、“减小”或“不变”).
(5)若在标准状况下有2.24L氧气参加反应,丙装置中阴极析出铜的质量为 .
(6)若将丙装置改成在标准状况下,用石墨作电极电解体积为2L的CuSO4溶液,写出电解CuSO4溶液时的离子反应方程式;当电解适当时间后断开电源,发现只需补充22.2g固体Cu2(OH)2CO3即可使电解液恢复到原浓度与体积,则原CuSO4溶液的浓度是mol/L;若将丙设计成在镀件上镀铜的装置,该如何改动,请用简要的语言叙述: .
(7)若将乙中的交换膜去掉,发现只有H2逸出,则试写出乙池中发生的总反应: .
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系:

(1)推断各符号所代表的物质的化学式:
A____________,B____________,C____________,D____________,E____________。
(2)分别写出反应②、⑤的化学方程式:
②______________________________________,
⑤__________________________________________。
(3)写出反应③的离子方程式____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上常用隔膜电解法将乙醛转化为乙醇和乙酸来处理高浓度乙醛废水。探究性学习小组用如图所示装置电解一定浓度的乙醛-Na2SO4溶液,模拟乙醛废水的处理过程。下列说法正确的是
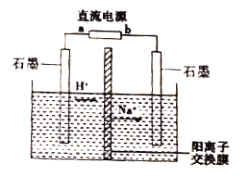
A. a 为直流电源的负极
B. 阳极的电极反应为:CH3CHO-2e-+H2O=CH3COOH+2H+
C. 电解过程中,阴极区的pH逐渐减小
D. 理论上阳极区处理废水的能力是阴极区的两倍
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求回答下列问题: I.将等物质的量的A、B混合放于2L的密闭容器中,发生反应3A(g)+B(g)xC(g)+2D(g).经5min后达到平衡,平衡时测得D的浓度为0.5mol/L,c(A):c(B)=3:5,v(C)=0.1mol/(Lmin).则:
(1)x= .
(2)前5min内B的反应速率v(B)= .
(3)平衡时A的转化率为 .
(4)II.水蒸气通过炙热的碳层发生反应:C(s)+H2O(g)CO(g)+H2(g)△H. 已知:K(300℃)<K(350℃),则该反应是热反应.
(5)上述反应在t0时刻达到平衡,在t1时刻改变某一条件后正反应速率(ν正)随时间的变化如下图所示,填出对应的编号. 
①缩小容器体积; ②降低温度
(6)已知反应①CO(g)+CuO(g)CO2(g)+Cu(s)②H2(g)+CuO(g)Cu(s)+H2O(g) 在相同的某温度下的平衡常数分别为K1和K2 , 该温度下反应CO(g)+H2O(g)CO2(g)+H2(g)的平衡常数K=(用K1和K2表示).
查看答案和解析>>
科目: 来源: 题型:
【题目】铁矿石主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。有一种测定铁矿石中含铁量的方法如下。
已知:2Na2S2O3+I2→Na2S4O6+2NaI

完成下列填空:
(1)步骤②用到的玻璃仪器除烧杯外,还有_________、_________,步骤⑤中必须用到的定量实验仪器是___________________。
(2)步骤③对应反应的离子方程式为______________________________________________。
(3)步骤④中煮沸的作用是__________________________________________。
(4)步骤⑦可用淀粉作为滴定终点的指示剂,达到滴定终点时的现象是_________________。若滴定过程中有空气进入,则测定结果_______。(选填“偏高”、“偏低”或“无影响”)
(5)若过程⑦中消耗0.5000mol·L1 Na2S2O3溶液20.00mL,则铁矿石中铁的百分含量为___。
查看答案和解析>>
科目: 来源: 题型:
【题目】2SO2(g)+O2(g)![]() 2SO3(g)+Q,是接触法生产硫酸的主要反应之一。
2SO3(g)+Q,是接触法生产硫酸的主要反应之一。
完成下列填空:
(1)生产过程中温度控制在400℃~500℃,目的是__________________________________;该反应无需加压的原因是____________________________________________________。
(2)上述反应在密闭容器中达到化学平衡状态的标志为______________________________。
(3)上述反应的平衡常数表达式为__________________________________,随着温度升高,平衡常数__________________(选填“增大”、“减小”或“不变”)。
(4)接触法生产硫酸尾气中含有SO2,可以采用氨水吸收,生成(NH4)2SO3与NH4HSO3的混合溶液。反应所得(NH4)2SO3又可以将NO2转化为N2和(NH4)2SO4。
① 写出生成NH4HSO3的化学方程式__________________________________________。
② 书写NO2与(NH4)2SO3反应的化学方程式,标出该反应中电子转移的方向和数目__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com