
科目: 来源: 题型:
【题目】已知A、B、F是家庭中常见的有机物,E是石油化工发展水平的标志,F是一种常见的高分子材料。根据下面转化关系回答下列问题:
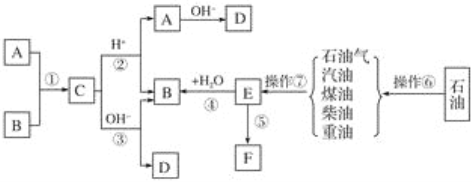
(1)操作⑥、操作⑦的名称分别为________、________。
(2)下列物质中沸点最高的是________。
A.汽油 B.煤油
C.柴油 D.重油
(3)在①~⑤中属于取代反应的是________;原子利用率为100%的反应是________。(填序号)
(4)写出结构简式:A________、F________。
(5)写出反应③的离子方程式:____________________________________________________。
(6)作为家庭中常见的物质F,它给我们带来了极大的方便,同时也造成了环境污染,这种污染称为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某种烃的衍生物分子式为C2H6O,下面是探讨其分子结构的过程,请回答相关问题:
(1)按价键理论,写出C2H6O可能有的结构式(用A、B、C……标明序号)_________________;
(2)取一定量的C2H6O与足量的金属钾反应,收集产生的气体,当完全反应时,C2H6O与产生的气体物质的量之比为2∶1。
①产生的气体能燃烧,火焰呈淡蓝色,燃烧产物通入无水硫酸铜,固体变蓝色;通入澄清石灰水,不变浑浊,则C2H6O与钾反应产生的气体是______________________________;
②据实验数据,可确定C2H6O的结构式为(写自编号)________,推断过程是_______________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组研究溶液中Fe2+与NO2、NO3的反应。资料: [Fe(NO)]2+在溶液中呈棕色。

(1)研究现象a中的黄色溶液。
①用______溶液检出溶液中含有Fe3+。
②甲认为是O2氧化了溶液中的Fe2+。乙认为O2不是主要原因,理由是______。
③进行实验Ⅱ,装置如图。左侧烧杯中的溶液只变为黄色,不变为棕色,右侧电极上产生无色气泡,经检验该气体为NO。

产生NO的电极反应式是______。
实验Ⅱ的目的是______。
(2)研究现象a中的棕色溶液。
①综合实验Ⅰ和实验Ⅱ,提出假设:现象a中溶液变为棕色可能是NO与溶液中的Fe2+或Fe3+发生了反应。进行实验Ⅲ,证实溶液呈棕色只是因为Fe2+与NO发生了反应。实验Ⅲ的操作和现象是______。
②加热实验Ⅰ中的棕色溶液,有气体逸出,该气体在接近试管口处变为红棕色,溶液中有红褐色沉淀生成。解释产生红褐色沉淀的原因是______。
(3)研究酸性条件下,溶液中Fe2+与NO2、NO3的反应。
序号 | 操作 | 现象 |
ⅰ | 取1 mol·L1的NaNO2溶液,加醋酸至pH=3,加入1 mol·L1FeSO4溶液 | 溶液立即变为棕色 |
ⅱ | 取1 mol·L1的NaNO3溶液,加醋酸至pH=3,加入1 mol·L1FeSO4溶液 | 无明显变化 |
ⅲ | 分别取0.5 mL 1 mol·L1的NaNO3溶液与1 mol·L1的FeSO4溶液,混合,小心加入0.5 mL浓硫酸 | 液体分为两层,稍后,在两层液体界面上出现棕色环 |
①ⅰ中溶液变为棕色的离子方程式是______、______。
②ⅲ中出现棕色的原因是______。
实验结论:本实验条件下,溶液中NO2、NO3的氧化性与溶液的酸碱性等有关。
查看答案和解析>>
科目: 来源: 题型:
【题目】某同学想通过实验探究硫和碳得电子能力的强弱,通过比较它们最高价氧化物对应水化物的酸性强弱来验证,设计了如图实验。

(1)仪器a的名称是________,应盛放下列药品中的________(填字母)。
A.稀硫酸 B.亚硫酸C.氢硫酸 D.盐酸
(2)仪器b的名称是________,应盛放下列药品中的________(填字母)。
A.碳酸钙 B.硫酸钠 C.氯化钠 D.碳酸钠
(3)仪器c中应盛放的试剂是________,如果看到的现象是____________________,证明b中反应产生了________,即可证明________比________酸性强,得电子能力________比________强,b中发生反应的离子方程式为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】甲醇既可用于基本有机原料,又可作为燃料用于替代矿物燃料.
(1)以下是工业上合成甲醇的反应:CO(g)+2H2(g)CH3OH(g)△H 下表所列数据是该反应在不同温度下的化学平衡常数(K).
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断反应I为热反应(填“吸”或“放”).
某温度下,将2mol CO和6mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)=0.2mol/L,则CO的转化率为 , 此时的温度为(从表中选择).
(2)已知在常温常压下: ①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g)△H1 kJ/mol
②2CO(g)+O2(g)=2CO2(g)△H2 kJ/mol
③H2O(g)=H2O(l)△H3 kJ/mol
则反应 CH3OH(l)+O2(g)=CO(g)+2H2O(l)△H=kJ/mol(用△H1、△H2、△H3表示)
(3)现以甲醇燃料电池,采用电解法来处理酸性含铬废水(主要含有Cr2O72)时,实验室利用如图装置模拟该法: 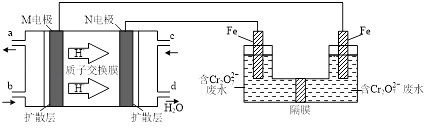
①N电极的电极反应式为 .
②请完成电解池中Cr2O72转化为Cr3+的离子反应方程式:
Cr2O72+Fe2++═Cr3++Fe3++
(4)处理废水时,最后Cr3+以Cr(OH)3形式除去,当c(Cr3+)=1×10-5molL﹣1 时,Cr3+沉淀完全,此时溶液的pH= . (已知,Ksp=6.4×10-31 , lg2=0.3)
查看答案和解析>>
科目: 来源: 题型:
【题目】以铝土矿(主要成分为Al2O3)为原料,用真空氯化亚铝(AlCl)歧化法,无需进行分离提纯,直接制备金属Al。其反应过程主要由两步组成,如下图:

(1)已知:
Al2O3 (s) + 3C (s)![]() 2Al (l) + 3CO (g) ΔH=+1346 kJ·mol 1
2Al (l) + 3CO (g) ΔH=+1346 kJ·mol 1
3AlCl (g)![]() AlCl3 (g) + 2Al (l) ΔH=140 kJ·mol 1
AlCl3 (g) + 2Al (l) ΔH=140 kJ·mol 1
①第一步反应的热化学方程式是______。
②第二步AlCl分解反应的化学平衡常数K随温度升高而______(填“增大”、“不
变”或“减小”)。
(2)第一步是可逆反应,选择在接近真空条件下进行,其原因是______。
(3)第二步反应制备的Al中含有少量C,可能的原因是______(不考虑未反应的C,写出1种即可)。
(4)如图为真空AlCl歧化法制备Al的实验装置示意图,控制AlCl3的凝华装置、Al的生成装置和AlCl的制备装置的温度分别为T1、T2、T3,其由高到低的顺序是______。

(5)制备Al的整个过程中可循环利用的物质是______。
查看答案和解析>>
科目: 来源: 题型:
【题目】为消除燃煤烟气中含有的SO2、NOx,研究者提出了若干烟气“脱硫”、“脱硝”的方法。
(1)向燃煤中加入适量石灰石,高温时将SO2转化为CaSO4的化学方程式是______。
(2)选择性催化还原法(SCR)“脱硝”。在催化剂的作用下,选取还原剂将烟气中的NO进行无害化处理。NH3还原NO的化学方程式是______。
(3)以NaClO溶液作为吸收剂进行一体化“脱硫”、“脱硝”。控制溶液的pH=5.5,将烟气中的SO2、NO转化为SO42、NO3,均为放热反应。
①在如图中画出“放热反应”的反应过程中的能量变化示意图。
②NaClO溶液吸收烟气中SO2的离子方程式是______。
③一定时间内,温度对硫、硝脱除率的影响曲线如图,SO2的脱除率高于NO,可能的原因是______(写出1种即可)。

④烟气中SO2和NO的体积比为4∶1,50℃时的脱除率见图2,则此吸收液中烟气转化生成的NO3和Cl的物质的量之比为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com