
科目: 来源: 题型:
【题目】控制适合的条件,将反应2Fe3++2I﹣2Fe2++I2设计成如图所示的原电池.下列判断不正确的是( ) 
A.反应开始时,乙中石墨电极上发生氧化反应
B.反应开始时,甲中石墨电极上Fe3+被还原
C.电流计读数为零时,反应达到化学平衡状态
D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极
查看答案和解析>>
科目: 来源: 题型:
【题目】75号元素铼,熔点仅次于钨,是制造航空发动机的必需元素。地壳中铼的含量极低,多伴生于钼、铜、锌、铅等矿物中。回答下列问题:
(1)锰与铼处于同一族,锰原子价层电子的轨道表示式(价层电子排布图)为_______,它处于周期表的_____区。
(2)与铼伴生的铜能形成多种配合物。如:醋酸二氨合铜(I)[Cu(NH3)2]Ac可用于吸收合成氨中对催化剂有害的CO气体:[Cu(NH3)2Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
[Cu(NH3)3]Ac·CO。(Ac表示醋酸根)
①与铜离子形成配合物的分子或离子应具备的结构特征是___________________________。
②配位体NH3中N原子的杂化类型为_____,1mol 配离子[Cu(NH3)2]+中含有σ键的数目为______。
③写出与CO 互为等电子体的一种离子的化学式__________________。
(3)金属铼的熔点高于锰,试从原子结构的角度加以解释_________________________________________________。
(4)三氧化铼为立方晶胞,晶胞参数为3.74A(1A=10-10m),铼原子占据顶点,氧原子占据所有棱心。则铼原子的配位数为_______,三氧化铼的密度为____g/cm3。(用NA表示阿伏加德罗常数的值,写计算式即可)
查看答案和解析>>
科目: 来源: 题型:
【题目】“低碳生活,绿色出行”已经成为很多人的生活理念。CO2的捕捉和利用也成为了科学家们积极探索的热门领域。回答下列问题:
(1)用CO2催化加氢可制取乙烯,其能量关系如图1,写出该反应的热化学方程式____________。

(2)以硫酸作电解质溶液,利用太阳能电池将CO2转化为乙烯的工作原理如图2。则A为电池的___极,N极的电极反应式为_________________________。
(3)用CO2催化加氢制取二甲醚的反应为:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
在恒容密闭容器中,均充入2mol.CO2和6molH2,分别以Ir和Ce作催化剂,反应进行相同的时间后测得的CO2的转化率a(CO2)随反应温度的变化情况如图3。

①用Ir和Ce作催化剂时,反应的活化能更低的是_______。
②a、b、c、d和e五种状态,反应一定达到平衡状态的是__________,反应的△H ___0(填“>”、“=”或“<”)。
③从状态a到c,CO2转化率不断增大的原因是________________________________。
④状态e时,a(CO2)= 50%,若保持容器容积为10L,则此时的平衡常数K=____。
查看答案和解析>>
科目: 来源: 题型:
【题目】铁镍蓄电池放电时的总反应式为Fe+Ni2O3+3H2O═Fe(OH)2+2Ni(OH)2 , 下列有关该电池的说法正确的是( )
A.电池的负极为Ni2O3 , 正极为Fe
B.电池的电解液可能是碱性溶液,也可能是酸性溶液
C.电池放电时,正极反应式为 ![]() ═
═ ![]()
D.电池充电时,阳极附近溶液的pH升高
查看答案和解析>>
科目: 来源: 题型:
【题目】NaBiO3可作为钢铁分析中测定锰的氧化剂,Bi2O3在电子行业有着广泛应用,可利用浮选过的辉铋矿(主要成分是Bi2S3,还含少量SiO2等杂质)来制备。其工艺流程如下:

回答下列问题:
(1)辉铋矿的“浸出液”中铋元素主要以Bi3+形式存在,写出Bi2S3与FeCl3 溶液反应的离子方程式:_____________________;加入盐酸,既可提高铋的浸出率,又可_____________________;滤渣1的主要成分是_____和硫。
(2)NaBiO3 是为数不多的钠盐沉淀之一,由溶液3 制得纯净的NaBiO3,操作2 包括_________。
(3) Bi2O3 与Na2O2 可在熔融状态下反应制得NaBiO3,其副产物为____________________。
(4)写出“煅烧”中由碱式碳酸铋[(BiO)2CO3]制备Bi2O3的化学方程式:_____________________。
(5) 某工厂用m1 kg 辉铋矿(含Bi2O360%)制备NaBiO3,最终得到产品m2kg,产率为_________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机化合物M的结构简式如图所示,有关化合物M的叙述正确的是( ) 
A.M的分子式为C13H18O3
B.M一定条件下,可以发生加成、酯化、水解等反应
C.1mol M与足量金属钠反应,可生成标准状况下的H211.2 L
D.1mol M最多能与4mol H2发生加成反应
查看答案和解析>>
科目: 来源: 题型:
【题目】最近中央电视二台报道,市场抽查吸管合格率较低,存在较大的安全隐患,其中塑化剂超标是一个主要方面,塑化剂种类繁多,其中邻苯二甲酸二酯是主要的一大类,![]() (代号DMP)是一种常用的酯类化剂,其蒸气对氢气的相对密度为97。工业上生产DMP的流程如图所示:
(代号DMP)是一种常用的酯类化剂,其蒸气对氢气的相对密度为97。工业上生产DMP的流程如图所示:

已知:R-X+NaOH![]() R-OH+NaX
R-OH+NaX
(1)上述反应⑤的反应类型为___________________。
(2)D中官能团的名称为___________________。
(3)DMP的结构简式为___________________。
(4)B→C的化学方程式为_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有X、Y、Z、W四种短周期元素,原子序数依次增大。X元素原子的半径最小。Z、W在周期表中处于邻位置,它们的单质在通常状况下均为无色气体。Y原子的最外层电子数是次外层子数的2倍。请回答:
(1)Z2的电子式为___________,YW2的结构式为____________。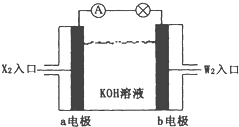
(2)将X2、W2按上图所示通入某燃料电池中,其中,b电极的电极反应式为__________________。若有16gW2参加反应,转移的电子数是____________。
(3)由X、Y、Z、W四种元素组成的无机酸酸式盐_______(化学式),与足量的NaOH溶液在加热条件下反应的离子方程式为________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】按要求填写:
(1)含有12个氢原子的烷烃分子式__________________。其同分异构体共有________种;
(2)除去乙酸乙酯中含有的少量乙酸可用____________(填试剂名称);
(3)己烯、乙酸和葡萄糖组成的混合物中,氧元素的质量分数是32%,则氢元素的质量分数为__________________________;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com