
科目: 来源: 题型:
【题目】(1)固体可分为晶体、非晶体和准晶体三大类,可通过________________方法区分晶体、非晶体和准晶体,以色列科学家丹尼尔·谢赫特曼因发现锰的化合物准晶体而独享了2011年诺贝尔化学奖。基态Mn原子的电子排布式为_______________。
(2)PCl3的立体构型为______________,中心原子的杂化轨道类型_______________。
(3)硼的卤化物在工业中有重要作用,硼的四种卤化物的沸点如下表所示。
BF3 | BCl3 | BBr3 | BI3 | |
沸点/K | 172 | 285 | 364 | 483 |
①四种卤化物沸点依次升高的原因是___________________。
②B、C、N、O三种元素第一电离能由小到大的顺序为___________。
③用BF3分子结构解释反应BF3(g)+NH4F(s)=NH4BF4(s)能够发生的原因:____________。
(4)碳元素的单质有多种形式,下图依次是C60、石墨和金刚石的结构图:
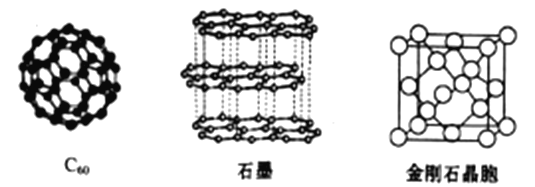
回答下列问题
①石墨晶体中,层内C-C键的键长为142pm,而金刚石中C-C键的键长为154pm,其原因是金刚石中只存在C-C间的________共价键,而石墨层内的C-C间存在_________键。
②金刚石晶胞含有___________个碳原子。若碳原子半径为r,金刚石晶胞的边长为a,列式表示碳原子在晶胞中的空间占有率__________(不要求计算结果)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列各项中,属于微量元素的是
A. C、H、N、P、Mn
B. Cl、Fe、S、N、Mg
C. B、Cu、Zn、Mn、Mo
D. N、P、K、Cu、Fe、I
查看答案和解析>>
科目: 来源: 题型:
【题目】25 ℃时,将pH=2的强酸溶液与pH=13的强碱溶液混合,所得混合液的pH=11,则强酸溶液与强碱溶液的体积比是(忽略混合后溶液的体积变化)
A. 11∶1 B. 9∶1 C. 1∶11 D. 1∶9
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 马口铁(镀锡)的表面一旦破损,铁腐蚀加快 B. 白铁(镀锌)的表面一旦破损,铁腐蚀加快
C. 用铝质铆钉铆接铁板,铁易被腐蚀 D. 钢铁设备上装上镁合金是阴极保护法
查看答案和解析>>
科目: 来源: 题型:
【题目】金属钒被誉为“合金的维生素”,常用于催化剂和新型电池。钒(V)在溶液中主要以VO43-(黄色)、VO2+(浅黄色)、VO2+ (蓝色)、V3+(绿色)、V2+(紫色)等形式存在。回答下列问题:
(1)已知:4Al(s)+3O2(g)=2Al2O3(s) △H1 4V(s)+5O2(g)=2V2O5(s) △H2
写出V2O5与Al 反应制备金属钒的热化学方程式__________________。(反应热用△H1、△H2表示)
(2) V2O5具有强氧化性,溶于浓盐酸可以得到蓝色溶液(含有VO2+),试写出V2O5与浓盐酸
反应的化学反应方程式:_________________________________。
(3)VO43-和V2O74-在pH≥13的溶液中可相互转化。室温下,1.0mol·L-1的Na3VO4溶液中c(VO43-)随c(H+)的变化如图所示。溶液中c(H+)增大,VO43-的平衡转化率_________(填“增大”“减小”或“不变”)。根据A点数据,计算该转化反应的平衡常数的数值为________。
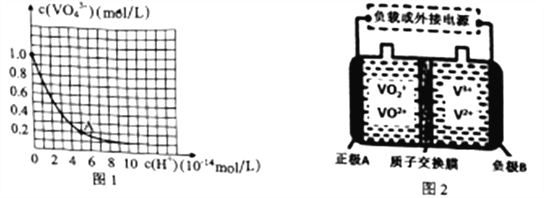
(4)全钒液流电池是一种优良的新型蓄电储能设备,其工作原理如图2所示:
①放电过程中,A电极的反应式为___________________。
②充电过程中,B电极附近溶液颜色变化为___________________。
③若该电池放电时的电流强度I=2.0A,电池工作10分钟,电解精炼铜得到铜mg,则电流利用率为______________(写出表达式,不必计算出结果。已知:电量Q=It,t为时间/秒;电解时Q=znF,z为每摩尔物质得失电子摩尔数,n为物质的量,法拉弟常数F=96500C/mol,电流利用效率=![]() ×100%)
×100%)
查看答案和解析>>
科目: 来源: 题型:
【题目】人工肾脏可采用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如下图所示。下列说法不正确的是( )

A. B为电源的负极
B. 阳极室中发生的反应依次为:2Cl--2e-=Cl2↑,CO(NH2)2+3Cl2+H2O=N2+CO2+6HCl
C. 电解结束后,阴极室溶液的pH与电解前相比一定会减小
D. 若两极共收集到气体13.44 L(标准状况),则理论可去除尿素为7.2g(忽略气体的溶解)
查看答案和解析>>
科目: 来源: 题型:
【题目】1.76 g铜镁合金完全溶解于50 mL、密度为1. 40 g cm-3、质量分数为63%的浓硝酸中,得到NO2气体1 792 mL(标准状况),向反应后的溶液中加入适量的1.0 mol L-1的NaOH 溶液,恰使溶液中的金属离子全部沉淀。下列说法不正确的是
A. 该浓硝酸中的HNO3的物质的量浓度是14.0 mol L-1
B. 加入NaOH溶液的体积是50 mL
C. 浓硝酸在与合金的反应中起了酸性和氧化性的双重作用,且起氧化性的硝酸的物质的量为0.08 mol
D. 得到的金属氢氧化物的沉淀为3.12 g
查看答案和解析>>
科目: 来源: 题型:
【题目】牛通过吃草获得化合物和元素,那么,牛和草体内的各种化学元素( )
A. 种类大体相同,含量差异很大
B. 种类和含量差异都很大
C. 种类和含量都是大体相同的
D. 种类差异很大,含量大体相同
查看答案和解析>>
科目: 来源: 题型:
【题目】用Pt作电极电解MgCl2溶液,下列关于电解装置正确的是( )
A. 总反应式:Mg+2H2O= Mg(OH) 2↓+H2↑
B. 负极反应式:Mg2+-2e-= Mg
C. 总反应式:Mg+2H2O= Mg(OH) 2+H2↑
D. 阴极电极反应式:2H++2e-= H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com