
科目: 来源: 题型:
【题目】H2、CO、CH4、CH3OH等都是重要的能源,也是重要为化工原料。
(1)已知25℃,1.01×105Pa时,,8.0DgCH4完全燃烧生成二氧化碳气体和液态水放出444.8kJ热量。写山该反应的热化学反应方程式:____________________。
(2)为倡导“节能减排”和“低碳经济”,降低大气中CO2的含量及有效地开发利用CO2,工业上可以用CO2来生产燃料甲醇。
在体积为2L的密闭容器中,充入lmolCO2和3molH2,一定条件下发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
CH3OH(g)+H2O(g)。经测得CO2和CH3OH(g)的物质的量随时间变化如图所示。
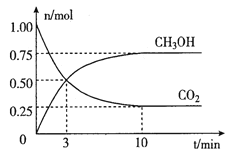
①从反或开始到平衡,CO2的平均反应速率v(CO2)=____。
②达到平衡时,H2的转化率为__________。
③下列措施不能提高反应速率的是__________。
A.升高温度 B.加入催化剂 C.增大压强 D.及时分离出CH3OH
(3)工业上也用CO和H2为原料制备CH3OH,反应方程式为:CO(g)+2H2(g)![]() CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
CH3OH(g),在一体积固定的密闭容器中投入一定量的CO和H2气体进行上述反应。下列叙述中能说明上述反应达到平衡状态的是______。
A.反应中CO与CH3OH的物质的量之比为1:1
B.混合气体的压强不随时间的变化而变化
C.单位时间内每消耗1molCO,同时生成1mclCH3OH
D.CH3OH的质量分数在混合气体中保持不变
E.混合气体的密度保持不变
查看答案和解析>>
科目: 来源: 题型:
【题目】根据阿伏加德罗理论:在相同温度和压强下,相同体积的任何气体都含有相同数目的粒子。在一定温度和压强下,1体积的A2气体和3体积的B2气体合成2体积的C气体,则C气体的化学式为:( )
A.AB3B.ABC.A3 BD.A2 B3
查看答案和解析>>
科目: 来源: 题型:
【题目】已知在标准状况下,气体摩尔体积约为22.4L/mol。则在常温常压下(25℃,101kPa)0.2mol气体A的体积为 ( )
A.4.48LB.大于4.48LC.小于4.48LD.无法确定
查看答案和解析>>
科目: 来源: 题型:
【题目】下列叙述正确的是( )
A. 等质量的CH4和苯完全燃烧耗氧量后者更大
B. SO2使溴水褪色与乙烯使酸性KMnO4褪色原理相同
C. 油脂皂化反应得到高级脂肪酸和甘油
D. 纤维素、聚乙烯、光导纤维都属于高分子化合物
查看答案和解析>>
科目: 来源: 题型:
【题目】2017年我国承建全球首艘深海采矿船,具2500米深海作业能力,对未来深海矿产资源的开发具有重要战略价值。海洋深处有丰富的锰结核矿(主要成分为MnO2,含少量Fe、Al等杂质元素),利用锰结核矿可以制备高纯碳酸锰,请回答下列有关问题:
(1)写出用MnO2和浓盐酸制取氯气的化学方程式________________。
(2)MnO2与过氧化氢的反应十分复杂。在酸性条件下,MnO2可以被H2O2还原成Mn2+,但H2O2又有氧化性,有研究表明,H2O2溶液的氧化性是HO2-所致。其他条件相同时,研究不同初始pH条件下H2O2溶液的漂白效果,结果如图所示:
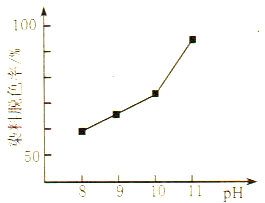
①写出MnO2在酸性条件下与H2O2反应的离子方程式____________。
②由图可得到的结论是_________,结合平衡移动原理简述理由:__________。
(3)利用锰结核矿在实验室制备高纯碳酸锰的流程如下:
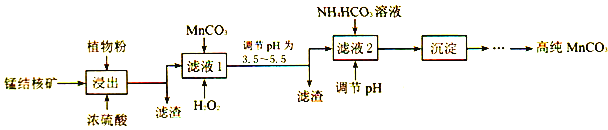
①可用SO2代替植物粉,植物粉的作用是___________。
②使用碳酸锰调pH的优势是___________。
③加入NH4HCO3时,温度要控制在35℃以下,其目的是___________。
(4)在废水处理中常用H2S将Mn2+转化为MnS除去,向含有0.020mo/LMn2+的废水中通入一定量的H2S气体,调节溶液的pH,当c(HS-)=1.0×10-4mol/L时,Mn2+开始沉淀,则此时溶液的pH=______。[已知:Ksp(MnS)=1.4×10-15;H2S的电离常数K1=1.3×10-7,K2=7.0×10-15]
查看答案和解析>>
科目: 来源: 题型:
【题目】常温下将NaOH 溶液滴加到H2X 溶液中,混合溶液的pH与 、
、 的变化关系如图所示。下列叙述正确的是
的变化关系如图所示。下列叙述正确的是

A. H2X 为二元强酸
B. 当 = 1时,溶液中c(HX-)=c(H2X)
= 1时,溶液中c(HX-)=c(H2X)
C. NaHX 溶液中c(H+)-)
D. 当溶液pH=4.6 时c(HX-)>c(X2-)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示.下列说法不正确的是已知: ①Ni2+在弱酸性溶液中发生水解
②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)( )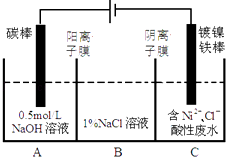
A.碳棒上发生的电极反应:4OH﹣﹣4e﹣═O2↑+2H2O
B.为了提高Ni的产率,电解过程中需要控制废水pH
C.电解过程中,B中NaCl溶液的物质的量浓度将不断减小
D.若将图中阳离子膜去掉,将
A.B两室合并,则电解反应总方程式发生改变
查看答案和解析>>
科目: 来源: 题型:
【题目】下表是稀硫酸与某金属反应的实验数据:
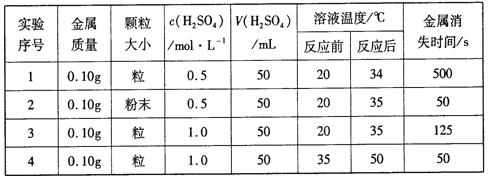
分析上述数据,回答下列问题:
(1)实验1和2表明,_____对反应速率有影响;实验1和3表明,______对反应速率与影响。
(2)室温下,将完全相同的锌片分别投入100mL0.1mol/L的稀硫酸和100mL0.2mol/L的稀盐酸中,仔细观察后发现,两者反应速率有明显差异:投入到稀硫酸中的锌表面产生的气泡没有投入到稀盐酸中的快。经分析讨论大家认为产生这一现象的原因有两种可能:
a、氯离子对反应起了促进作用,即氯离子加快了反应的进行;
b、____(你的观点)。
要证明你的观点,可以在室温下,分别取100mL0.1mol/L的盐酸溶液于两个相同的烧杯中,一个烧杯中加一定量的____固体(填所加试剂化学式),另一个烧杯作对比实验,再分别同时加入完全相同的锌片,比较两烧杯中反应速率的大小。
(3)在用锌粒和稀硫酸反应制取氢气时,往往加人少量CuSO4粉末,可加快产生H2的速率,其原因是_________(用文字表达)。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是元素周期表的一部分。按要求填写下列空白:
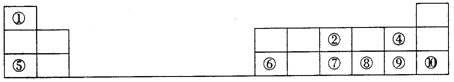
(1)元素⑦在周期表中的位置可表示为_______。
(2)①~⑩元素的最高价氧化物对应的水化物中,酸性最强的是_______ (填化学式)。
(3)④⑧⑨三种元素形成的气态氢化物稳定性由大到小的顺序是_______(用化学式表示)。
(4)⑤和⑥两种元素的最高价氧化物对应的水化物反应的离子方程式为_______。
(5)为了证明⑤和⑥两种元素的金属性强弱,下列说法或实验能提供证据的是_______。
A.比较两种元素的单质的熔点、沸点高低
B.将两种元素的单质分别与冷水反应,观察反应的剧烈程度
C.比较两种元素的最高价氧化物对应的水化物的碱性强弱
(6)铁元素处在周期表第四周期第Ⅷ族,它在地壳中含量仅次于铝。全世界每年都有大量的钢铁因生锈而损失。钢铁发生电化学腐蚀时,负极反应是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com