
科目: 来源: 题型:
【题目】硒(Se)、碲(Te)为VIA族元素,是当今高新技术新材料的主要成分之一,电解精炼铜的阳极泥主要成分为Cu2Te、Ag2Se和少量金属单质及其他化合物,工业上从其中回收碲、硒的一种工艺流程如下:

已知:
I.Se 单质难溶于水。TeO2微溶于水,易溶于较浓的强酸和强碱;
II.元素碲在溶液中主要以Te4+、TeO32-、HTeO3-等形式存在;
III.25℃时,亚碲酸(H2TeO3)的Ka1=1×10-3,Ka2=2×10-8。
(1)Se的氢化物的电子式是_______________。0.1mol/L的H2TeO3电离度(当弱电解质在溶液里达到电离平衡时,溶液中已经电离的电解质分子数占原来总分子数的百分数叫做电离度) 约为_____________________。
(2) 加入浓硫酸焙烧前常将阳极泥中大块颗粒先粉碎,其目的是_______________________。
(3) SeO2 与SO2在冷却后通入水中反应的化学方程式_________________________________。反应后分离出Se单质的操作①为_________________(填操作名称)。
(4)焙砂中碲以TeO2形式存在,与足量NaOH溶液反应后得到的溶液①,其溶质的主要成分为_______(填化学式,过量的NaOH除外)。工业上也可以通过电解溶液①得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为__________________________________。
(5)向溶液①中加入硫酸时控制溶液的pH 为4.5~5.0,生成TeO2沉淀,如果H2SO4过量,将导致碲的回收率__________(填“偏高”、“偏低”或“无影响”)。
(6)将纯净的TeO2先溶于盐酸得到四氯化碲,然后再将SO2通入到溶液中得到Te单质,请写出由四氯化碲得到Te单质的离子方程式________________________________。
(7)上述流程中可循环利用的物质_______________(填化学式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】太阳能电池的发展已经进入了第三代。第三代就是铜铟镓硒CIGS等化合物薄膜太阳能电池以及薄膜硅系太阳能电池。完成下列填空:
(1)亚铜离子(Cu+)基态时的电子排布式为_______________________。
(2)比较硒和同周期相邻的元素砷的第一电离能I1的大小:I1(As)__I1(Se)。用原子结构观点加以解释______________________________________________。
(3)与镓元素处于同一主族的硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成加合物,如BF3能与NH3 反应生成BF3·NH3,BF3·NH3中N 原子的杂化轨道类型为__________________,B与N 之间形成________键。
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得如图所示的金刚砂(SiC) 结构。金刚砂晶体属于_________(填晶体类型),在SiC结构中,每个C原子周围最近的C原子数目为___________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】在2L密闭容器中,800℃时反应2NO(g)+O2(g)2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K= , 已知:K(300℃)>K(350℃),该反应是反应(填“放热”或“吸热”).
(2)图中表示NO2的变化的曲线是 , 用O2的浓度变化表示从0~2s内该反应的平均速率v= . 
(3)能说明该反应已经达到平衡状态的是 a.v(NO2)=2v(O2) b.容器内压强保持不变
c.v逆(NO)=2v正(O2) d.容器内物质的密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是 a.及时分离出NO2气体 b.适当升高温度
c.增大O2的浓度 d.选择高效的催化剂.
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于化学反应的说法正确的是( )
A.化学反应常伴随能量的变化
B.反应条件是加热的反应都是吸热反应
C.放热反应都不需要加热就能发生
D.化学反应中的能量变化仅有热量变化
查看答案和解析>>
科目: 来源: 题型:
【题目】在C2H2、C6H6、C2H4O组成的混合物中,已知碳元素的质量分数为84%,则混合物中氧元素的质量分数是( )
A. 9% B. 8% C. 7% D. 12%
查看答案和解析>>
科目: 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. Cl2通入水中:Cl2+H2O = 2H++Cl-+ClO-
B. AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓+3NH4+
C. H2SO4加入Ba(OH)2溶液中:Ba2++SO42-=BaSO4↓
D. 盐酸酸化的H2O2加入FeSO4溶液中:Fe2++H2O2+2H+= Fe3++2H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于“碳”的认识,不正确的是
A. 每个单体都以若干个相连的碳原子构成的碳链为基本骨架
B. 碳是生命的核心元素,没有碳就没有生命
C. 人体细胞鲜重中碳的含量高达55.99%
D. 相同质量的脂肪与糖原相比,脂肪中碳素所占比例更高
查看答案和解析>>
科目: 来源: 题型:
【题目】请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上可利用CO或CO2来制备清洁液体燃料甲醇。已知: 800℃时
反应①:2H2(g)+CO(g)![]() CH3OH(g) △H=-90.8 kJ/mol
CH3OH(g) △H=-90.8 kJ/mol
反应②:H2(g)+CO2(g)![]() H2O(g)+CO(g) △H=+41.2kJ/mol
H2O(g)+CO(g) △H=+41.2kJ/mol
(1)写出用CO2与H2反应制备甲醇的热化学方程式___________________________________。
(2)对于反应①,在体积一定的密闭容器中按物质的量之比1:2充入CO和H2,测得平衡混合物中CH3OH的体积分数在不同压强下随温度的变化如图1所示。据此判断
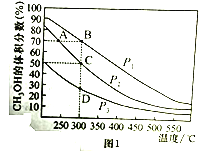
①压强P1_____P2(填“>”“<”或“=”,下同)
②平衡常数K(状态C)_____K(状态D)
③反应速率:V逆(状态A)_____V逆(状态B)
(3)对于反应②,在体积一定的密闭容器中加入一定量的H2和CO。进行反应。下列说法正确的是______。
A.若该反应在恒容,绝热的容器中进行,当容器中压强保持不变时表明反应达到平衡状态
B.该反应达到平衡时,向平衡体系中充入一定量的氦气,平衡可能发生移动
C.恒温恒容条件下,若改变反应物的投入量,△H的值不发生变化
D.恒温恒容条件下,若投入气体的总量保持不变,设起始投料比[n(H2)/n(CO2)]=X,当X=2或1/2时,H2O的体积分数不变。
(4)利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2。紫外线照射时,在不同催化剂(I、II、III)作用下,CH4产量随光照时间的变化如下图2所示,在0-15h内,对反应催化效果最好的催化剂是____________(填序号)。
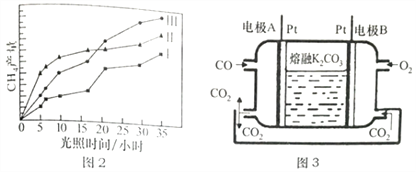
(5)一种新利CO燃料电池工作原理如上图3所示,该电池负极电极反应式为______________,电极A处产生的CO2有部分参与循环利用,其利用率为______________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】25℃时,用NaOH溶液滴定H2C2O4溶液,溶液中-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)或-1g[c(H+)/c(HC2O4-)]和-1gc(C2O42-)关系如图所示,下列说法正确的是

A. 曲线L1表示-1g[c(H+)/c(H2C2O4)]和-1gc(HC2O4-)的关系
B. Ka2(H2C2O4)的数量级为10-2
C. NaHC2O4溶液中c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
D. 向0.lmol/LH2C2O4溶液中加入少量水[c(HC2O4-)/c(H2C2O4)]减小
查看答案和解析>>
科目: 来源: 题型:
【题目】北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大火炬燃料是丙烯(C3H6)
(1)丙烷脱氢可得丙烯.已知:C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJmol﹣1CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=+32.4kJmol﹣1 则相同条件下,反应C3H8(g)→CH3CH=CH2(g)+H2(g)的△H=kJmol﹣1
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2 , 负极通入丙烷,电解质是熔融碳酸盐.电池总反应方程式为;放电时,CO32﹣移向电池的(填“正”或“负”)极.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10﹣5 molL﹣1 . 若忽略水的电离及H2CO3的第二级电离,则H2CO3![]() HCO3﹣+H+的平衡常数K1= . (已知:10﹣5.60=2.5×10﹣6)
HCO3﹣+H+的平衡常数K1= . (已知:10﹣5.60=2.5×10﹣6)
(4)常温下,0.1molL﹣1NaHCO3溶液的pH大于8,则溶液c(H2CO3)c(CO32﹣)(填“>”、“=”或“<”),原因是(用离子方程式和文字说明)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com