
科目: 来源: 题型:
【题目】化学能与热能、电能等可以相互转化,下列说法正确的是
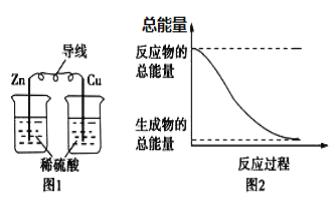
A. 图1所示的装置能将化学能转变为电能
B. 图2所示的反应为吸热反应
C. 化学反应中能量变化的主要原因是化学键的断裂与生成
D. 中和反应中,反应物的总能量比生成物的总能量低
查看答案和解析>>
科目: 来源: 题型:
【题目】某兴趣小组设计如下微型实验装置.实验时,先断开K2 , 闭合K1 , 两极均有气泡产生;一段时间后,断开K1 , 闭合K2 , 发现电流表指针偏转,下列有关描述正确的是( ) 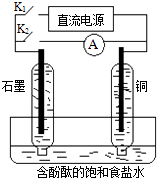
A.断开K2 , 闭合K1时,总反应的离子方程式为:2H++2Cl﹣ ![]() Cl2↑+H2↑
Cl2↑+H2↑
B.断开K2 , 闭合K1时,石墨电极附近溶液变红
C.断开K1 , 闭合K2时,铜电极上的电极反应为:Cl2+2e﹣=2Cl﹣
D.断开K1 , 闭合K2时,石墨电极作正极
查看答案和解析>>
科目: 来源: 题型:
【题目】加热N2O5时,发生以下两个反应:N2O5N2O3+O2 , N2O3N2O+O2 . 在1L密闭容器中加热4molN2O5 , 达到平衡时,c(O2)为4.5mol/L,c(N2O3) 为1.62mol/L,则c(N2O5) 为( )
A.1.44mol/L
B.3.48mol/L
C.0.94mol/L
D.1.98mol/L
查看答案和解析>>
科目: 来源: 题型:
【题目】如图是室温下,向100mL盐酸中逐渐加入NaOH溶液时,溶液的pH变化图象.根据图象所得结论正确的是( ) 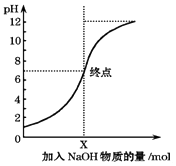
A.原来盐酸的物质的量浓度为0.1mol/L
B.NaOH溶液的浓度为0.1mol/L
C.pH=1和pH=7的点对应溶液中水的电离程度相同
D.X点NaOH溶液的体积为100mL
查看答案和解析>>
科目: 来源: 题型:
【题目】下列化学用语或模型正确的是( )
A. CH4分子的比例模型:![]() B. 乙醇的结构简式:C2H6O
B. 乙醇的结构简式:C2H6O
C. Al3+的结构示意图:![]() D. 氯化钙的电离方程式:CaCl2===Ca2++Cl2-
D. 氯化钙的电离方程式:CaCl2===Ca2++Cl2-
查看答案和解析>>
科目: 来源: 题型:
【题目】通过石油裂化和裂解可以得到乙烯、丙烯、甲烷等重要化工基本原料。目前,仅有10%产量的石油转化为化工、医药等行业的基本原料加以利用。用石油裂化和裂解过程得到的乙烯、丙烯来合成丙烯酸乙酯的路线如下:

已知:CH3CHO![]() CH3COOH
CH3COOH
根据以上材料和你所学的化学知识回答下列问题:
(1)由CH2=CH2制得有机物A的化学反应方程式是_____________,反应类型是___________。
(2)有机物B中含有的官能团为_________、_________ (填名称)。
(3)写出A与B合成丙烯酸乙酯的反应方程式是___________________________,反应类型是______。其中浓硫酸所起的作用是___________。
(4)在沙漠中,喷洒一定量的聚丙烯酸乙酯,能在地表下30~50厘米处形成一个厚0.5厘米的隔水层,既能阻断地下盐分上升,又有拦截蓄积雨水的作用,可使沙漠变成绿洲。写出丙烯酸乙酯在引发剂作用下聚合成聚丙烯酸乙酯的化学方程式____________________,反应类型是____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有机玻璃的单体甲基丙烯酸甲酯(MMA) 的合成原理如下:
 (MMA)
(MMA)
下列说法正确的是
A. 若反应①的原子利用率为100%,则物质X为CO2
B. 可用分液漏斗分离MMA和甲醇
C. ![]() 、
、![]() 均可发生加成反应、氧化反应、取代反应
均可发生加成反应、氧化反应、取代反应
D. MMA与H2反应生成Y,能与NaHCO3溶液反应的Y的同分异构体有3种
查看答案和解析>>
科目: 来源: 题型:
【题目】根据要求回答下列问题:
①CaBr2 ②NH4Cl ③H2O2 ④Na2O2 ⑤ HClO ⑥Al
(1)只含有离子键的是(用序号回答,下同)___________________________,并用电子式表示该化合物的形成过程_________________________________________;
(2)含有共价键的离子化合物是__________,并写出其中含有非极性键化合物的电子式___________;
(3)属于共价化合物的是_________________,并写出只含有极性键化合物的电子式___________;
(4)熔融状态能导电的化合物是_________________________________;
(5)熔融状态时和固态时,都能导电的是__________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】a.某有机物A化学式为CxHyOz,15 gA完全燃烧生成22 gCO2和9 gH2O。试确定:
(1)该有机物的最简式______________;
(2)若A的相对分子质量为60且和Na2CO3混合有气体放出,A和醇能发生酯化反应,则A的结构简式为 _______________ ;
(3)若A的相对分子质量为60且是易挥发有水果香味的液体,能发生水解反应,则其结构简式为______________;
(4)若A分子结构中含有6个碳原子,具有多元醇和醛的性质,则其结构简式为_______。
b.有机物A、B、C、D在一定条件下有如图所示的转化关系:

请回答下列有关问题:
(1)写出B的分子式:____________________。
(2)分别写出反应①的反应方程式______________和②的反应方程式________________________
(3)③的反应类型为___________________________。
(4)两分子D在浓硫酸存在的条件下加热可以发生自身的酯化反应生成E或F,且E的相对分子质量比F的小,则E和F的结构简式分别为___________________、_________________。
(5)下列关于有机物A的说法正确的有__________________(填序号)。
a.含有氢氧根离子,具有碱性
b.能发生加聚反应
c.能使溴水褪色
d.在一定条件下能与冰醋酸反应
查看答案和解析>>
科目: 来源: 题型:
【题目】某研究小组探究电解FeCl2溶液的电极反应产物
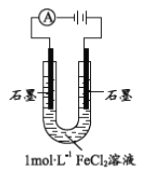
(1)配制1molL-1FeCl2溶液,测得pH=4.91,原因______(用离子方程式表示)。从化合价角度分析, Fe2+具有________。
(2)该小组同学预测电解FeCl2溶液两极的现象:阳极有黄绿色气体产生,阴极有无色气体产生。
该小组同学用右图装置电解1molL-1FeCl2溶液:
①取少量银灰色固体洗涤后,加稀H2SO4有气泡产生,再向溶液中加入________(试剂和现象),证明该固体为Fe。
②该小组同学进一步分析红褐色固体产生的原因,甲同学认为________;乙同学认为2Cl- - 2e- = Cl2↑,Cl2可氧化Fe2+最终生成Fe(OH)3 。
为证实结论,设计方案如下:用实验Ⅰ的装置和1.5v 电压,电解酸化(pH=4.91)的_______,通电5分钟后,阳极无明显现象,证实乙同学的推论不正确。丙同学认为仍不严谨,原因是产生的气体溶于水,继续实验________(操作和现象),进一步证实了乙同学的推论不正确。
(3)该小组同学进一步探究电解1molL-1FeCl2溶液电极产物的影响因素。
实验 | 条件 | 操作及现象 | ||
电压 | pH | 阳极 | 阴极 | |
Ⅰ | 1.5v | 4.91 | 无气泡产生,溶液逐渐变浑浊,5分钟后电极表面析出红褐色固体 | 无气泡产生,4分钟后电极表面有银灰色金属状固体附着 |
Ⅱ | 1.5v | 2.38 | 无气泡产生,溶液出现少量浑浊,滴加KSCN溶液变红色 | 无气泡产生,电极表面有银灰色金属状固体附着 |
Ⅲ | 1.5v | 1.00 | 无气泡产生,溶液无浑浊现象,滴加KSCN溶液变红色 | 有气泡产生,无固体附着 |
Ⅳ | 3.0v | 4.91 | 无气泡产生,溶液逐渐变浑浊,3分钟后电极表面有红褐色固体产生 | 极少量气泡产生,1分钟出现镀层金属 |
Ⅴ | 6.0v | 4.91 | 有气泡产生,遇湿润的淀粉碘化钾试纸变蓝。溶液逐渐变浑浊 | 大量气泡产生,迅速出现镀层金属 |
①对比实验Ⅰ、Ⅱ、Ⅲ可以得出结论:
阳极Fe2+放电时,酸性较强主要生成Fe3+; 酸性较弱主要生成Fe(OH)3 。阴极________。
②对比实验Ⅰ、Ⅳ、Ⅴ可以得出结论:
增大电压,不仅可以改变离子的放电能力,也可以________。
(4)综合分析上述实验,电解过程中电极反应的产物与________有关 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com