
科目: 来源: 题型:
【题目】为配制0.1mol/L CuSO4溶液,下列说法中,正确的是( )
A.取25g CuSO4·5H2O溶于1L水中
B.取16g CuSO4·5H2O溶于水配成1L溶液
C.将 CuSO4·5H2O加热,除去结晶水后取16g溶于1L水中
D.将25g CuSO4·5H2O溶于水,用容积为1000mL的容量瓶配成1L溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】离子M2O7X-与S2-能在酸性溶液中发生如下反应:M2O7X-+3S2-+14H+=2M3+ +3S +7H2O,则M2O7X-中M的化合价为( )
A.+4B.+5C.+6D.+7
查看答案和解析>>
科目: 来源: 题型:
【题目】氮及其化合物在生活和生产中应用广泛。
I.(1)N2O是一种典型的温空气体,在一定条件下,其分解的化学方程式为:2N2O(g)==2N2(g) +O2(g) △H________________。
(2)已知一定条件下有下列反应:
①2N2O5(g)![]() 4NO2(g)+ O2(g) △H1
4NO2(g)+ O2(g) △H1
②2NO2(g)![]() 2NO(g)+ O2(g) △H2
2NO(g)+ O2(g) △H2
③2NaOH(aq)+ N2O5(g)![]() 2NaNO3(aq)+H2O(1) △H3
2NaNO3(aq)+H2O(1) △H3
写出NO与O2的混合物溶于NaOH 溶液生成硝酸盐的热化学方程式_____________________________。在容积为2L 的恒容密闭容器中充入1.00mol N2O5,假设在T℃时只发生反应①、②,若达到平衡状态后O2 为1.00mol,NO2为0.400mol,则T℃时反应①的平衡常数的值为_______________________。
II.联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(3)联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式_______________。
(4)在高温下,N2H4可完全分解为NH3、N2及H2,实验测得分解产物中N2与H2的物质的量之比为3:2,则该分解反应的化学方程式为_____________________________________。
(5)SCR法是工业上消除氮氧化物的常用方法,反应原理为:4NH3(g) +4NO(g) +O2(g) ![]() 4N2(g) +6H2O(g)△H<0其他条件相同,某2L密闭容器中分别投入2mol NH3、2molNO、lmolO2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。下列叙述不正确的是_________。
4N2(g) +6H2O(g)△H<0其他条件相同,某2L密闭容器中分别投入2mol NH3、2molNO、lmolO2,在甲、乙两种催化剂作用下,NO转化率与温度的关系如图所示。下列叙述不正确的是_________。
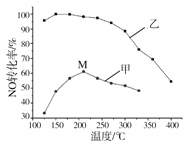
A.在催化剂甲作用下,图中Y点处(210℃) NO的转化率一定不是该温度下的平衡转化率
B.在催化剂甲作用下,高于210℃时,NO转化率降低的原因可能是催化剂活性降低
C.300℃时,NO的平衡转化率M点高于Z点的原因是乙催化剂催化效率高
D.其他条件不变,增加NH3的浓度,正反应速率增大,逆反应速率减小,平衡向正反应方向移动
III.NH3是一种重要的化工原料。
(6)NH3和Cr2O3 固体高温下可以制备多功能材料CrN晶体,其反应为Cr2O3 (s) +2NH3(g) ![]() 2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因_____________________________________________。
2CrN(s)+3H2O(g)。在800℃时,为降低相同时间内收集到的粗产品中氧的含量,通过提高反应器中NH3(g)流量的工艺手段达成,请解释可能的原因_____________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】用A+、B-、C2-、D、E、F分别表示含有18个电子的几种微粒(离子或分子),请回答下列问题:
(1)A元素是________、B元素是________、C元素是________(用元素符号表示)。
(2)B的单质可用来制“84”消毒液的主要成分,写出反应的离子方程式_____________。
(3)用文字描述比较B、C两元素的非金属性强弱的方法(必要时可用方程式,至少一条):________________。
(4)D是由两种元素组成的双原子分子,用电子式表示其形成过程___________________。
(5)E是所有含18个电子的微粒中氧化能力最强的分子,其与水反应的化学方程式为________。
(6)F分子中含有4个原子,既有极性键又有非极性键,其电子式是_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于钠与水反应的说法不正确的是( )
A.将小块钠投入滴有石蕊试液的水中,反应后溶液变蓝
B.将钠投入稀盐酸中,钠先与水反应,后与盐酸反应
C.钠投入到水中会有大量氢气产生
D.钠投入到滴有酚酞的水溶液中,烧杯中的溶液变红
查看答案和解析>>
科目: 来源: 题型:
【题目】生活中应注重食谱营养搭配的均衡性,下列午餐食谱中最有利于学生身体发育的是
A. 馒头、榨菜、黄瓜、香蕉
B. 面条、醋溜土豆丝、素炒白菜
C. 米饭、糖醋排骨、粉蒸肉、清蒸鲈鱼
D. 米饭、红烧鲫鱼、西红柿蛋汤、蒜蓉生菜、苹果
查看答案和解析>>
科目: 来源: 题型:
【题目】下列离子方程式正确的是( )
A.往硝酸银溶液中滴加少量氨水:Ag++2NH3═[Ag(NH3)2]+
B.尼泊金酸( ![]() )与碳酸氢钠溶液反应:
)与碳酸氢钠溶液反应: ![]()
C.乙醛的银镜反应:CH3CHO+2[Ag(NH3)2]++2OH﹣ ![]() CH3COO﹣+NH4++2Ag↓+3NH3+H2O
CH3COO﹣+NH4++2Ag↓+3NH3+H2O
D.苯酚钠溶液中通入CO2:2C6H5O﹣+CO2+H2O→2C6H5OH+CO32﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】Sn 元素位于元素周期表第IVA 族,SnCl4可用作媒染剂和催化剂,工业上常用氯气与金属锡在300℃反应制备SnCl4。SnCl4 极易水解,SnCl2、SnCl4的一些物理数据如下:
物质 | 状态 | 熔点/℃ | 沸点/℃ |
Sn | 银白色固体 | 232 | 2260 |
SnCl2 | 无色晶体 | 246 | 652 |
SnCl4 | 无色液体 | -33 | 114 |
用下列装置合成四氯化锡(夹持装置略)。注:在仪器3 中各加入0.6 mL浓硫酸,实验操作如下:

I.把干燥的仪器按图示装置连接好,在仪器1中加入B mL浓盐酸,在仪器2中加入2.0g KMnO4,在仪器5中加入2~3颗Sn粒;
II.打开活塞,让盐酸流下,均匀产生Cl2并充满整套装置,然后加热Sn粒,将生成的SnCl4收集在仪器6中;
III.Sn粒反应完毕后,停止加热,同时停止滴加盐酸,取下仪器6,迅速盖好盖子。
请回答:
(1)写出仪券2中发生化学反应方程式________________________。
(2)下列说法不正确的是______。
A.装置连接好,加入药品前要检查装置的气密性
B.产生的Cl2先充满整套装置,这步操作不可以省略
C.操作中应控制盐酸的滴入速率,不能太快,也不能太慢
D.仪器6 可用冰水浴冷却,也可以自然冷却
(3)仪器7 放的试剂是_______________________,作用是___________________、__________________。
(4)SnCl4在空气中与水蒸气反应除生成白色SnO2·xH2O固体,还可以看到___________________现象,化学方程式为___________________________________。
(5)经测定产品中含有少量的SnCl2,可能的原因___________( 用化学方程式表示)。
(6)产品中含少量SnCl2,测定SnCl4纯度的方法:取0.400 g产品溶于50 mL的稀盐酸中,加入淀粉溶液作指示剂,用0.0100mol/L碘酸钾标准溶液滴定至终点,消耗标准液8.00 mL,反应原理为:3SnCl2+ KIO3+ 6HCl==3SnCl4+ KI+ 3H2O,判断滴定终点的依据为______________________________,产品的纯 度为___________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com