
科目: 来源: 题型:
【题目】某科学小组制备硝基苯的实验装置如下,有关数据列如下表。已知存在的主要副反应有:在温度稍高的情况下会生成间二硝基苯。

实验步骤如下:
取100mL烧杯,用20 mL浓硫酸与足量浓硝酸配制混和酸,将混合酸小心加入B中。把18 mL(15.84 g)苯加入A中。向室温下的苯中逐滴加入混酸,边滴边搅拌,混和均匀。在50~60℃下发生反应,直至反应结束。
将反应液冷却至室温后倒入分液漏斗中,依次用少量水、5%NaOH溶液和水洗涤。分出的产物加入无水CaCl2颗粒,静置片刻,弃去CaCl2,进行蒸馏纯化,收集205~210℃馏分,得到纯硝基苯18g。
回答下列问题:
(1)图中装置C的作用是____________________。
(2)制备硝基苯的化学方程式_____________________。
(3)配制混合酸时,能否将浓硝酸加入到浓硫酸中_________(“是”或“否”),说明理由:____________________。
(4)为了使反应在50℃~60℃下进行,常用的方法是______________。反应结束并冷却至室温后A中液体就是粗硝基苯,粗硝基苯呈黄色的原因是_____________________。
(5)在洗涤操作中,第二次水洗的作用是_____________________。
(6)在蒸馏纯化过程中,因硝基苯的沸点高于140℃,应选用空气冷凝管,不选用水直形冷凝管的原因是_______________________。
(7)本实验所得到的硝基苯产率是_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学——选修5:有机化学基础]
已知A是芳香烃,苯环上只有一个取代基,A完全加氢后分子中有两个甲基,E的分子式为C9H8O2,能使溴的四氯化碳溶液褪色,其可以用来合成新型药物H,合成路线如图所示。

已知:

请回答下列问题:
(1)写出有机物A的结构简式:____________。有机物D中存在的官能团名称为_______________。
(2)上述反应过程中属于取代反应的有________________(填序号)。
(3)有机物H在一定条件下可以聚合形成高分子,写出该聚合物的结构简式:_______________________。
(4)写出H在氢氧化钠催化作用下的水解方程式:_________________________。
(5)有机物E有多种同分异构体,写出符合下列条件的同分异构体的结构简式:_________________。
a.存在苯环且苯环上核磁共振氢谱只有2组峰值
b.与新制Cu(OH)2悬浊液作用产生砖红色沉淀
c.加入FeCl3溶液显色
(6)参照H的上述合成路线,设计一条由石油产品和NH2—CH(CH3)2为起始原料制备医药中间体CH3CONHCH(CH3)2的合成路线:___________________________________________________________________(需注明反应条件)。
查看答案和解析>>
科目: 来源: 题型:
【题目】某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“外界条件对化学反应速率的影响”.实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢,设计方案中一组数据如表:
编号 | H2C2O4溶液 | 酸性KMnO溶液 | 温度℃ | ||
浓度/(molL﹣1) | 体积/mL | 浓度/(molL﹣1) | 体积/mL | ||
① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
(1)已知反应后H2C2O4转化为CO2逸出,KMnO4溶液转化为MnSO4 , 标况下,每生成89.6LCO2气体,转移mol电子.写出H2C2O4与酸性KMnO4溶液反应的离子方程式 .
(2)实验①测得KMnO4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO4)=molL﹣1min﹣1 .
查看答案和解析>>
科目: 来源: 题型:
【题目】铜、铁、硒、钴、磷及其化合物在工业上有重要用途,回答下列问题:
(1)铁离子(Fe3+)最外层电子排布式为______,其核外共有______种不同运动状态的电子。Fe3+比Fe2+更稳定的原因是____________________________________。
(2)硒为第四周期元素,相邻的元素有砷和溴,则三种元素的电负性从大到小的顺序为________(用元素符号表示)。
(3)Na3[Co(NO2)6]常用作检验K+的试剂,Na3[Co(NO2)6]中存在的化学键有__________。
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如下左图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为______,其中心原子杂化轨道类型为__________,B为________。
(5)磷化铝晶胞如图所示,A1原子的配位数为________,若两个铝原子之间的最近距离为d pm,NA代表阿伏加德罗常数的值, 则磷化铝晶体的密度ρ=_________g/cm3。


查看答案和解析>>
科目: 来源: 题型:
【题目】现有下列几组物质:①O2和O3 ②35Cl和37Cl ③CH3CH3 和CH3CH2CH3
④CH3CH2CH(CH3)CH2CH3 和 CH3CH2CH(CH3)CH(CH3)CH3
⑤H2、D2 和 T2 ⑥
⑦CH3(CH2)2CH3 和 (CH3)2CHCH3 ⑧CH3CH(CH3)CH3 和 CH(CH3)3
⑨ 和
和
(1)互为同位素的有_______________________________;
(2)互为同素异形体的有___________________________;
(3)互为同分异构体的有___________________________;
(4)互为同系物的有_______________________________;
(5)属于同种物质的有_____________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的两种方法:
方法a | 用炭粉在高温条件下还原CuO |
方法b | 电解法,反应为2Cu+H2O |
(1)工业上常用方法b制取Cu2O而很少用方法a,其原因是反应条件不易控制,若控温不当易生成__而使Cu2O产率降低。
(2)已知:
①2Cu(s)+ ![]() O2(g)
O2(g)![]() Cu2O(s) ΔH1=-169 kJ·mol-1
Cu2O(s) ΔH1=-169 kJ·mol-1
②C(s)+ ![]() O2(g)
O2(g)![]() CO(g) ΔH2=-110.5 kJ·mol-1
CO(g) ΔH2=-110.5 kJ·mol-1
③Cu(s)+![]() O2(g)
O2(g)![]() CuO(s) ΔH3=-157 kJ·mol-1
CuO(s) ΔH3=-157 kJ·mol-1
则方法a中发生的反应:2CuO(s)+C(s)= Cu2O(s)+CO(g);△H=________。
(3)方法b是用肼燃料电池为电源,通过离子交换膜电解法控制电解液中OH-的浓度来制备纳米Cu2O,装置如图所示:
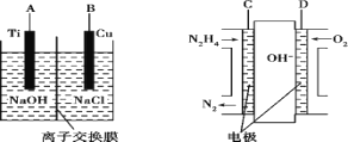
①上述装置中B电极应连_________电极(填“C”或“D”)。
②该离子交换膜为____离子交换膜(填“阴”或“阳”),该电解池的阳极反应式为_______。
③原电池中负极反应式为______________。
(4)在相同体积的恒容密闭容器中,用以上方法制得的两种Cu2O分别进行催化分解水的实验:2H2O(g) ![]() 2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
2H2(g)+O2(g) ΔH>0。水蒸气的浓度随时间t的变化如下表所示:
序号 | 温度/℃c/mol·L-1t/min | 0 | 10 | 20 | 30 | 40 | 50 |
① | T1 | 0.050 | 0.049 2 | 0.048 6 | 0.048 2 | 0.048 0 | 0.048 0 |
② | T1 | 0.050 | 0.048 8 | 0.048 4 | 0.048 0 | 0.048 0 | 0.048 0 |
③ | T2 | 0.10 | 0.096 | 0.093 | 0.090 | 0.090 | 0.090 |
①催化剂的催化效率:实验①_______实验②(填“>”或“<”)。
②实验①、②、③的化学平衡常数K1、K2、K3的大小关系为________。
查看答案和解析>>
科目: 来源: 题型:
【题目】下图的各方框表示有关的一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
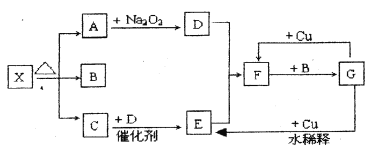
(1)C的电子式:_________________________;F的化学式:__________________________;
(2)写出下列变化的离子方程式或化学方程式:
G→E(离子方程式):_________________________________________________________;
A→D(化学方程式):_________________________________________________________;
(3)实验室制取气体C的化学方程式为___________________________________________,常采用____________________________法来收集气体C。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com