
科目: 来源: 题型:
【题目】有原子序数依次增大的 A、B、C、D、E、F 六种短周期元素;A 元素的原子半径是所有元素中原子最小的; C 元素的最高价氧化物对应水化物与其氢化物能生成盐 M;E 与 A 同主族,F 元素原子的最外层电子数比次外层电子数少 2;A、B、C、E、F这五种元素,每﹣种与 D 元素都能形成原子个数比不相同的若干种化合物.请回答:
(1)D 元素在周期表中的位置为 .
(2)可以比较 D 和 F 得电子能力强弱的是(填写编号).
a.比较这两种元素原子半径的大小
b.二者形成的化合物中,D 元素的原子显负价
c.比较这两种元素的气态氢化物的稳定性
(3)盐 M 中含有的化学键类型有;并写出其中阳离子的电子式 .
(4)固体氧化物燃料电池(SOFC)以固体氧化物作为电解质.其工作原理如下图所示.
①固体氧化物中的 O2﹣向(填“正”或“负”)极移动.
②电极 b 为电池极
③若A2 作为燃料气,则接触面上发生的反应为 .
④若B2A4作为燃料气,则接触面上发生的反应为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】有机物A(C11H12O5)同时满足下列条件:①含苯环且不含甲基;②苯环上一氯取代物只有2种;③1 mol A与足量的NaHCO3反应生成1 mol CO2;④遇FeCl3溶液不显色。A有如图所示转化关系:
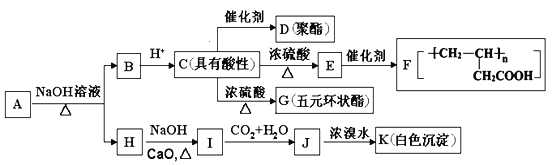
已知: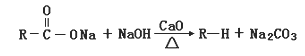
回答下列问题:
(1)E中官能团名称_____________________,H的分子式为_____________________。
(2)由C生成G的反应类型是____________________。
(3)A的结构简式为_____________________,G的结构简式为___________________。
(4)①写出C→D反应的化学方程式__________________________________________;
②写出I→J反应的离子方程式__________________________________________。
(5)C的同分异构体中能同时满足下列条件:a.能发生银镜反应,b.能发生皂化反应;c.能与Na反应产生H2,共有__________种(不含立体异构)。其中核磁共振氢谱显示为3组峰,且峰面积比为6∶1∶1的是_________________________(写结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】氯化镉(CdCl2)是一种常用于薄膜太阳能电池上的物质,由于它有毒,科学家选用了另一种盐来替代它。这种替代物质是( )
A. Cl2 B. HCl C. MgCl2 D. Mg(OH)2
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ.消除汽车尾气中的NO、CO,有利于减少PM2.5的排放。已知如下信息:

b.①N2(g)+O2(g)===2NO(g) ΔH1
②2CO(g)+O2(g)===2CO2(g) ΔH2=-565 kJ·mol-1
(1)ΔH1=________。
(2)在催化剂作用下NO和CO转化为无毒气体,写出反应的热化学方程式:_________。
Ⅱ. SO2、CO、NOx是对环境影响较大的气体,对它们的合理控制和治理是优化我们生存环境的有效途径。请回答下列问题:
(1)已知25℃、101 kPa时:
①2SO2(g)+O2(g)![]() 2SO3(g) ΔH1=-197 kJ·mol-1
2SO3(g) ΔH1=-197 kJ·mol-1
②H2O(g)===H2O(l) ΔH2=-44 kJ·mol-1
③2SO2(g)+O2(g)+2H2O(g)===2H2SO4(l) ΔH3=-545 kJ·mol-1
则SO3(g)与H2O(l)反应的热化学方程式是______________________。
(2)若反应2H2(g)+O2(g)===2H2O(g)
ΔH=-241.8 kJ·mol-1,根据下表数据求x=_______kJ·mol-1。
化学键 | H—H | O=O | O—H |
断开1 mol化学 键所需的能量/kJ | 436 | x | 463 |
查看答案和解析>>
科目: 来源: 题型:
【题目】美国“海狼”号潜艇上的核反应堆内使用了液体铝钠合金作载热介质,下列关于Al、Na原子结构的分析中正确的是( )
A. 原子半径:Al>Na
B. 第一电离能:Al>Na
C. 电负性:Na>Al
D. 基态原子未成对电子数:Na>Al
查看答案和解析>>
科目: 来源: 题型:
【题目】A是分子式为C7H8的芳香烃,已知它存在以下一系列转化关系,其中C是一种一元醇,D是A的对位一取代物,H与E、I与F分别互为同分异构体:
(1)化合物I的结构简式是 ,
(2)反应B﹣→C的化学方程式是: , 反应E﹣→F的化学方程式是: .
(3)设计实验证明H中含有溴原子,还需用到的试剂有 .
(4)为验证E﹣→F的反应类型与E﹣→G不同,下列实验方法切实可行的是 .
A.向E→F反应后的混合液中加入硝酸酸化,再加入AgNO3溶液得到淡黄色沉淀
B.向E→F反应后的混合液中加入溴水,发现溴水立即褪色
C.向E→F反应后的混合液中加入盐酸酸化后,加入溴的CCl4溶液,使之褪色
D.向E→F反应后的混合液中加入酸性KMnO4溶液,混合液红色变浅.
查看答案和解析>>
科目: 来源: 题型:
【题目】一定条件下,乙醛可发生分解:CH3CHO(l)![]() CH4+CO,已知该反应的活化能为190kJ.mol-1,在含有少量I2的溶液中,该反应的机理为:
CH4+CO,已知该反应的活化能为190kJ.mol-1,在含有少量I2的溶液中,该反应的机理为:
反应Ⅰ:CH3CHO+ I2![]() CH3I2+HI+CO (慢)
CH3I2+HI+CO (慢)
反应Ⅱ:CH3I+HI![]() CH4+ I2
CH4+ I2
下列有关该反应的叙述中正确的是( )
A.反应速率与I2的浓度有关
B.HI在反应Ⅰ中是氧化产物
C.反应焓变的绝对值等于190kJ.mol-1
D.乙醛的反应速率主要取决于反应Ⅱ
查看答案和解析>>
科目: 来源: 题型:
【题目】丙烯是三大合成材料的基本原料,可用于合成应用广泛的DAP树脂单体和双酚等有机物,具有重要的工业用途.
(1)写出丙烯在一定条件下发生聚合反应的化学方程式 .
(2)丙烯在乙酸作用下与O2反应生成有机物A,其蒸气密度是相同状况下甲烷密度的6.25倍,元素的质量分数为:碳60%、氧32%.A的分子式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】氮、氧、硫、磷、铁是与生命活动密切相关的元素。回答下列问题:
(1)N的基态原子最外电子层具有的原子轨道数为______。SO2分子的VSEPR模型名称是_________。
(2)N、O、P三种元素第一电离能由大到小的顺序是________。气态氢化物氨(NH3)和膦(PH3)的键角较大的是_________。
(3)SCN-中C原子的杂化类型为______,1 mol SCN-中含π键的数目为______NA。
(4)FeO的熔点____Fe2O3的熔点(填“<”、“>”或“=”),其原因是________________。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。磷化硼是一种超硬耐磨的涂层材料,其晶胞结构如图所示,其中原子坐标参数A为(0,0,0);B为(![]() ,
, ![]() ,0);D为(1,1,1)。则C原子的坐标参数为______。
,0);D为(1,1,1)。则C原子的坐标参数为______。

②晶胞参数,描述晶胞的大小和形状。P原子与B原子的最近距离为a cm,则磷化硼晶胞的边长为_____cm(用含a的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com