
科目: 来源: 题型:
【题目】已知:2C(s)+O2(g)===2CO(g) ΔH=-Q1kJ·mol-1;
C(s)+O2(g)===CO2(g) ΔH=-Q2kJ·mol-1;
S(s)+O2(g)===SO2(g) ΔH=-Q3kJ·mol-1。
CO与镍反应会造成镍催化剂中毒,为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫,则该反应的热化学方程式为 ( )
A. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-2Q2+Q3) kJ·mol-1
B. S(s)+2CO(g)===SO2(g)+2C(s) ΔH=(Q1-Q3) kJ·mol-1
C. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(Q1-2Q2+Q3) kJ·mol-1
D. SO2(g)+2CO(g)===S(s)+2CO2(g) ΔH=(2Q1-Q2+2Q3) kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】氰化钾K4Fe(CN)6俗名黄血盐,可溶于水,不溶于乙醇。以某电镀厂排放的含NaCN 度液为主要原料制备黄血盐的流程如下:

请回答下列问题:
(1)常温下,HCN 的电离常数Ka=62×10-10。
①实验室配制一定浓度的NaCN溶液时,将NaCN 溶解于一定浓度的NaOH 溶液中,加水稀释至指定浓度,其操作的目的是__________________________。
②浓度均为0.5mol/L的NaCN和HCN的混合溶液显___________(填“酸”“碱”或“中”)性,通过计算说明:_________________________。
(2)转化池中发生复分解反应生成K4Fe(CN)6,说明该反应能发生的理由:_________________。
(3)系列操作B 为_____________________。
(4)实验室中,K4Fe(CN)6可用于检验Fe3+,生成的难溶盐KFe[Fe(CN)6]可用于治疗Tl2SO4中毒,试写出上述治疗Tl2SO4中毒的离子方程式:______________________。
(5)一种太阳能电池的工作原理如图所示,电解质为铁氰化钾K3Fe(CN)6和亚铁氰化钾K4Fe(CN)6的混合溶液。

①K+移 向 催 化 剂___________(填“a”或“b”)。
②催化剂a 表面发生的反应为_____________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】三氯氧磷(POCl2)是重要的基础化工原料,广泛用于制药、染化。塑胶助剂等行业。某兴趣小组模拟PCl3直接氧化法制备POCl3,实验装置设计如下:
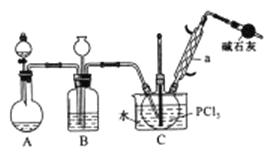
有关物质的部分性质如下表:
熔点/℃ | 沸点/℃ | 其他 | |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
POCl3 | 2 | 105.3 | 遇水生成H3PO4和HCl,能溶于PCl3 |
回答下列问题:
(1)装置A中发生反应的化学方程式为___________________________。
(2)B装置的作用除观察O2的流速之外。还有__________________________。
(3)C装置控制反应在60℃~65℃进行,其主要目的是_______________________。
(4)通过佛尔哈德法可以测定三氯氧磷产品中Cl元素含量,实验步骤如下:
Ⅰ.取xg 产品于锥形瓶中,加入足量NaOH 溶液,待完全反应后加稀硝酸至酸性。
Ⅱ.向锥形瓶中加入0.1000mol/L 的AgNO3容液40.00mL,使Cl-完全沉淀。
Ⅲ.向其中加入2mL硝基苯,用力摇动,使沉淀表面被有机物覆盖。
Ⅳ.加入指示剂,用cmol/LNH4SCN 溶液滴定过量Ag+至终点,记下所用 体积VmL。
已知:Ksp(AgCl)=3.2×10-10,Ksp(AgSCN)=2×10-12
①滴定选用的指示剂是________________(填标号)。
a.FeCl2 b.NH4Fe(SO4)2 c.淀粉 d.甲基橙
②Cl元素的质量百分含量为(列出算式)____________________。
③步骤Ⅲ加入硝基苯的目的是_________________,如无此操作,所测Cl元素含量将会____________填“偏大”“ 偏小”或“不变”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】(1)已知:①Fe(s)+![]() O2(g)=FeO(s) H1=-272.0kJ/mol
O2(g)=FeO(s) H1=-272.0kJ/mol
②2Al(s)+![]() O2(g)=Al2O3(s) H1=-1675.7kJ/mol
O2(g)=Al2O3(s) H1=-1675.7kJ/mol
Al和FeO发生铝热反应的热化学方程式是__________________。某同学认为,铝热反应可用于工业炼铁,你的判断是_____(填“能”或“不能”),理由是________。
(2)反应物与生成物均为气态的某可逆反应在不可条件下的反应历程分别为A、B如图所示。
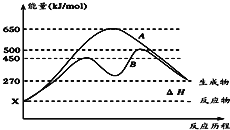
①据图判断该反应是_______(填“吸”或“放”)热反应。
②其中B历程表明此反应采用的条件为________(填字母)。
A.升高温度 B.增大反应物的浓度 C.降低温度 D.使用催化剂
(3)铝热法是常用的金属冷炼方法之一。已知:
4A1(s)+3O2(g)=2Al2O3(s) H=-3352kJ/mol
Mn(s)+O2(g)=MnO2(s)H=-521kJ/mol
Al与MnO2反应冶炼金属Mn的热化学方程式是___________________。
(4)中国气象局的数据显示,2013年企国平均雾霾天数为52年来之最。形成雾霾的主要成分为生产生活中排放的废气,汽车尾气及扬尘等。用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l)H=-955kJ/mol
2NO2(g)=N2O4(g) H=-56.9kJ/mol
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】液体感科电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH为电解质。下列关于该燃料电池的叙述不正确的是

A. 电流从右侧电极经过负载流向左侧电极
B. 负极发生的电极反应式为N2H4+4OH--4e-=N2+4H2O
C. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
D. 该燃料电池持续放电时,正极发生氧化反应,碱性减弱
查看答案和解析>>
科目: 来源: 题型:
【题目】我国古代就有湿法炼铜的记载“曾青得铁则化为铜”,反应为Fe + CuSO4 = Cu + FeSO4。下列有关该反应的说法正确的是
A.Fe是氧化剂B.CuSO4 为还原剂
C.Fe被还原D.CuSO4 发生还原反应
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA表示阿伏德罗常数的值,下列叙述正确的是
A.物质的量是一个物理量,它的单位是个
B.常温常压下,11.2 L H2所含的分子数为0.5 NA
C.1 mol 水的质量是18 g
D.MgCl2的摩尔质量为95
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,向2L恒容容器中充入1molA和1molB,发生反应A(g)+B(g)=C(g)经过一段时间后达到平衡,反应过程中测定的部分数据如表.下对说法正确的是( )
t/s | 0 | 5 | 15 | 25 | 35 | |
n(A)/mol | 1.0 | 0.85 | 0.81 | 0.80 | 0.80 |
A.前 5 s 的平均反应速率v(A)=0.03 molL﹣1s﹣1
B.正反应是吸热反应
C.保持温度不变,起始时向容器中充入2molC,达平衡时,C的转化率大于80%
D.保持温度不变,起始时向容器中充入0.2molA,0.2molB和1molC,反应达到平衡前v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com