
科目: 来源: 题型:
【题目】纳米CaCO3作为工业上重要的无机填充材料,广泛应用于橡胶、塑料、涂料、油墨和造纸等行业。某化学兴趣小组在实验室中利用下列装置模拟工业制备纳米CaCO3.
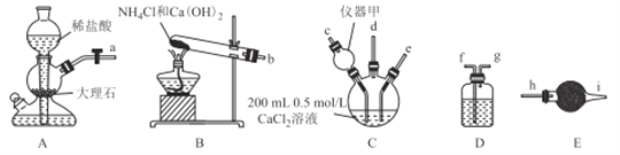
请回答下列问题:
(1)仪器甲的名称是________,在该实验中,其作用是_____.
(2)将上述接口连接顺序补充完整:a![]() ;b
;b![]() ;d
;d![]() 。__________
。__________
(3)装置D中选择的试剂是__________(填序号,下同),装置E中选择的试剂是__________
①饱和Na2CO3溶液 ②饱和NaHCO3溶液 ③无水CaCl2固体 ④碱石灰
(4)装置C中发生反应的离子方程式为__________
(5)随着气体的通入,三颈烧瓶中产生白色沉淀且逐渐增多,但一段时间后,白色沉淀逐渐减少,其可能的原因为_______(结合化学用语解释)。
(6)当生成5g沉淀时,理论上消耗两种气体(标准状况下)的总体积可能为_________
(7)已知:常温下,Ksp(CaCO3)=2.8×10-9,Ksp(CaSO3)=1.4×10-7。向浓度为1.0mol/L的Na2SO3溶液中加入纳米CaCO3,若使CaCO3向CaSO3转化,则该混合液中c(SO32-)/c(CO32-)的值(x)的取值范围为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】隔绝空气加热至500℃时绿矾(硫酸亚铁晶体)能完全分解,某化学小组为探究分解产物的成分,选用下图所示装置进行实验(夹持装置略),A中固体完全分解后变为红棕色粉末。

下列说法不正确的是
A. 所选用装置的正确连接顺序为A-C-E-D-B
B. E装置是用来检验SO3,则X可以是硝酸酸化的硝酸钡溶液
C. 可选用酸性KMnO4溶液检验A装置中残留固体是否为Fe2O3
D. 该反应的化学方程式可能是2FeSO4·7H2O=Fe2O3+SO2↑+SO3↑+14H2O
查看答案和解析>>
科目: 来源: 题型:
【题目】据媒体报道,法国一家公司Tiamat日前研发出比当前广泛使用的锂电池成本更低、寿命更长、充电速度更快的钠离子电池,预计从2020年开始实现工业生产。该电池的负极材料为Na2Co2TeO6(制备原料为Na2CO3、Co3O4和TeO2),电解液为NaClO4的碳酸丙烯酯溶液。
回答下列问题:
(1)Te属于元素周期表中_____区元素,其基态原子的价电子排布式为_____。
(2)基态Na原子中,核外电子占据的原子轨道总数为____,最高能层电子云轮廓图形状为_____
(3)结合题中信息判断:C、O、Cl的电负性由大到小的顺序为_____(用元素符号表示)。
(4)CO32-的几何构型为______;碳酸丙烯酯的结构简式如图所示,则其中碳原子的杂化轨道类型为_________,1mol碳酸丙烯酯中键的数目为________.

(5)[Co(H2O)6]3+的几何构型为正八面体形,配体是_____,该配离子包含的作用力为__(填选项字母)。
A.离子键 B.极性键 C.配位键 D.氢键 E.金属键
(6)Na和O形成的离子化合物的晶胞结构如图所示,晶胞中O的配位数为______,该晶胞的密度为ρg/cm3,阿伏加德罗常数的值为NA,则Na与O之间的最短距离为_____cm(用含ρ、NA的代数式表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】分枝酸可用于生化研究.其结构简式如图.下列关于分枝酸的叙述正确的是( ) 
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目: 来源: 题型:
【题目】醋酸乙烯(CH3COOCH=CH2)是一种重要的有机化工原料,以二甲醚(CH3OCH3)与合成气(CO、H2)为原料,醋酸锂、碘甲烷等为催化剂,在高压反应釜中一步合成醋酸乙烯及醋酸。
回答下列问题:
(1)常温下,将浓度均为a mol/L的醋酸锂溶液和醋酸溶液等体积混合,测得混合液的pH=b,则混合液中c(CH3COO-)=______mol/L( 列出计算式即可)。
(2)合成二甲醚:
Ⅰ.2H2(g)+CO(g)=CH3OH(g) ΔH1=-91.8kJ/mol;
Ⅱ.2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH2=-23.5 kJ/mol;
Ⅲ.CO(g)+H2O(g)=CO2(g)+H2(g) ΔH3=-41.3 kJ/mol.
已知:H-H 的键能为436kJ/mol,C=O的键能为803kJ/mol,H-O的键能为464kJ/mol,则C≡O的键能为_____kJ/mol.
(3)二甲醚(DME)与合成气一步法合成醋酸乙烯(VAC)的反应方程式为2CH3OCH3(g)+4CO(g)+H2(g) ![]() CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
CH3COOCH=CH2(g)+2CH3COOH(g),T℃时,向2L恒容密闭反应釜中加入0.2 molCH3OCH3、0.4 molCO、0.1molH2发生上述反应,10min达到化学平衡,测得VAC的物质的量分数为10%。
①0~10min内,用CO浓度变化表示的平均反应速率v(CO)=______;该温度下,该反应的平衡常数K=__________。
②下列能说明该反应达到平衡状态的是______(填选项字母)。
A.V正(DME)=v逆(H2)≠0
B.混合气体的密度不再变化
C.混合气体的平均相对分子质量不再变化
D.c(CO):c(VAC)=4:1
③如图是反应温度对二甲醚(DME)的转化率和醋酸乙烯(VAC)选择性(醋酸乙烯的选择性Svac=![]() )的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.
)的影响,该反应的ΔH______0(填“>”“<”或“=”);控制的最佳温度是___________.

④保持温度不变,向反应釜中通入氩气增大压强,则化学平衡______(填“向正反应方向”“向逆反应方向"或“不”)移动。
查看答案和解析>>
科目: 来源: 题型:
【题目】在C2H2、C6H6、C2H4O组成的混合物中,已知氧元素的质量分数为8%,则混合物中碳元素的质量分数是( )
A.92.3%
B.87.6%
C.75%
D.84%
查看答案和解析>>
科目: 来源: 题型:
【题目】冬青油结构如图,它在一定条件下能发生的反应有:( ) ①加成反应
②水解反应
③消去反应
④取代反应
⑤与NaHCO3反应放出CO2
⑥加聚反应.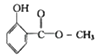
A.①②⑥
B.①②③
C.④⑤⑥
D.①②④
查看答案和解析>>
科目: 来源: 题型:
【题目】工业生产甲醇的常用方法是:CO(g)+2H2(g)=CH3OH(g) △H1=-90.8 kJ/mol。
已知:2H2(g)+O2(g)=2H2O(1) △H2=-571.6 kJ/mol
H2(g)+![]() O2(g)=H2O(g) △H3=-241.8 kJ/mol
O2(g)=H2O(g) △H3=-241.8 kJ/mol
下列有关说法正确的是
A. H2的燃烧热为241. 8 kJ/mol
B. CH3OH(g)+O2(g)=CO(g)+2H2O(g) △H=-392. 8 kJ/mol
C. “![]() ”既表示分子个数也能表示物质的量
”既表示分子个数也能表示物质的量
D. 未注明温度和压强时,△H表示标准状况下的数据
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com