
科目: 来源: 题型:
【题目】工业上制备纯硅反应的热化学方程式如下:SiCl4(g)+2H2(g)Si(s)+4HCl(g)△H=+QkJ/mol(Q>0)某温度、压强下,将一定量反应物通入密闭容器进行上述反应,下列叙述正确的是( )
A.反应过程中,若增大压强能提高SiCl4的转化率
B.若反应开始时SiCl4为1 mol,则达平衡时,吸收热量为Q kJ
C.反应至4 min时,若HCl浓度为0.12 mol/L,则H2的反应速率为0.03 mol/(Lmin)
D.反应吸收0.025Q kJ热量时,生成的HCl通入100 mL 1 mol/L的NaOH溶液中恰好完全反应
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于电解质的叙述,正确的是( )
A.NaCl溶液在电流作用下电离出Na+和Cl-
B.凡是溶于水后能电离出H+的化合物就叫酸
C.HCl溶液能导电,而液态的HCl难以导电
D.难溶物一定不属于电解质
查看答案和解析>>
科目: 来源: 题型:
【题目】2018年俄罗斯世界杯官方比赛用球,新足球名为“Telstar 18(电视之星18)”,脱胎于1970年世界杯上经典的“电视之星 (Telstar)”。为了契合本次世界杯的环保主题,Telstar 18选用了具有较高环保性能的高科技材料——三元乙丙橡胶(EPDM)。化合物A![]() 是合成三元乙丙橡胶的重要中间体,可由B(C5H6)和C经Diels-Alder反应制得。已知最简单的Diels-Alder反应是
是合成三元乙丙橡胶的重要中间体,可由B(C5H6)和C经Diels-Alder反应制得。已知最简单的Diels-Alder反应是![]() ,完成下列填空。
,完成下列填空。
(1)写出由B和C合成A的化学方程式:________________,该反应属于________(填反应类型)。
(2)写出与 ![]() 互为同分异构体,且一溴代物只有两种的芳香烃的结构简式:________________。分别写出生成这两种一溴代物所需要的反应试剂和反应条件①_______;②__________。
互为同分异构体,且一溴代物只有两种的芳香烃的结构简式:________________。分别写出生成这两种一溴代物所需要的反应试剂和反应条件①_______;②__________。
(3)已知:① CH3COONa+NaOH ![]() CH4↑+Na2CO3;
CH4↑+Na2CO3;
②
![]()
 ;
;
③ +CH3Br
+CH3Br![]()
![]() 。
。
利用所给信息,写出实验室由 制备
制备![]() 的合成路线。(合成路线常用的表示方式为:A
的合成路线。(合成路线常用的表示方式为:A ![]() B……
B……![]() 目标产物)__________。
目标产物)__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】苯可被臭氧分解,发生化学反应![]() ,二甲苯通过上述反应可能的产物为
,二甲苯通过上述反应可能的产物为![]() ,若邻二甲苯进行上述反应,对其反应产物描述正确的是
,若邻二甲苯进行上述反应,对其反应产物描述正确的是
A. 产物为a、b、c,其分子个数比为a∶b∶c=1∶2∶3
B. 产物为a、b、c,其分子个数比为a∶b∶c=1∶2∶1
C. 产物为a和c,其分子个数比为a∶c=1∶2
D. 产物为b和c,其分子个数比为b∶c=2∶1
查看答案和解析>>
科目: 来源: 题型:
【题目】某课题组以硫铁矿烧渣(含Fe2O3、Fe3O4、Al2O3、CaO、SiO2等)为原料制取软磁用Fe2O3(要求纯度>99.2%,CaO含量<0.01%)。其工艺流程如下(所加入试剂均稍过量):
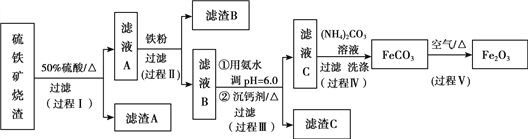
已知:生成氢氧化物的pH
Al(OH)3 | Fe(OH)2 | Fe(OH)3 | |
开始沉淀时 | 3.4 | 6.3 | 1.5 |
完全沉淀时 | 4.7 | 8.3 | 2.8 |
(1)滤渣A的主要成分是__________。
(2)在过程Ⅱ中可观察到产生少量气泡,溶液颜色慢慢变浅。能解释该实验现象的离子方程式有__________。反应后,可以用__________溶液检验说明Fe3+是否已经完全反应。
(3)在过程Ⅱ中,课题组对滤液A稀释不同倍数后,加入等质量的过量铁粉,得出Fe3+浓度、还原率和反应时间的关系如图所示:
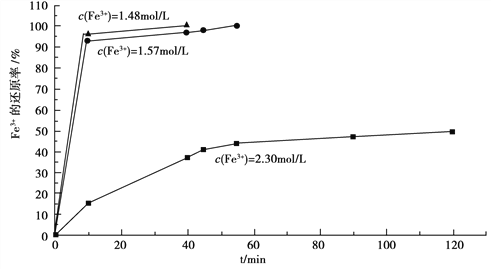
结合上述实验结果说明:课题组选择稀释后c(Fe3+)为1.60mol/L左右的理由是______。
(4)在过程Ⅲ中,课题组在相同条件下,先选用了不同沉钙剂进行实验,实验数据见下表:
(已知:滤液B中钙的含量以CaO计为290—310mg/L)
沉钙剂 | Na2SO3 | H2C2O4 | (NH4)2CO3 | Na2CO3 | NH4F |
用量/g | 2 | 2 | 2 | 5 | 2 |
剩余CaO/mg/L) | 290 | 297 | 290 | 190 | 42 |
根据实验结果,选择适宜的沉钙剂,得到滤渣C的主要成分有__________。
(5)在过程Ⅳ中,反应温度需要控制在35℃以下,不宜过高,其可能的原因是__________。
(6)在过程Ⅴ中,反应的化学方程式是__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】在下列溶液中能大量共存的无色透明离子组是( )
A.K+、Na+、NO3﹣、MnO4﹣
B.K+、Na+、Cl﹣、SO42﹣
C.K+、Na+、Br﹣、Cu2+
D.Na+、Ba2+、OH﹣、SO42﹣
查看答案和解析>>
科目: 来源: 题型:
【题目】硫是生物必须的营养元素之一,含硫化合物在自然界中广泛存在,循环关系如下图所示:
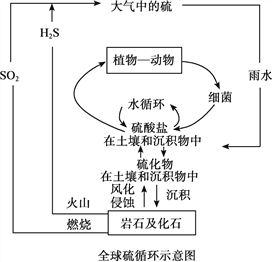
(1)火山喷发产生H2S在大气当中发生如下反应:
①2H2S(g)+O2(g)=2S(g)+2H2O(g) △H=﹣442.38kJ/mol
②S(g)+O2(g)=SO2(g) △H=﹣297.04kJ/mol。
H2S(g)与O2(g)反应产生SO2(g)和H2O(g)的热化学方程式是__________。
(2)自然界地表层原生铜的硫化物经氧化、淋滤作用后变成CuSO4溶液,向地下深层渗透遇到难溶的ZnS,慢慢转变为铜蓝(CuS),请从沉淀溶解平衡的角度解释由ZnS转变为CuS的过程__________。
(3)化石燃料燃烧时会产生含SO2的废气进入大气,污染环境,有多种方法可用于SO2的脱除。
①氨法脱硫。该方法是一种高效低耗能的湿法脱硫方式,利用氨水吸收废气中的SO2,并在富氧条件下氧化为硫酸铵,得到化肥产品。反应的化学方程式是__________。
②NaClO碱性溶液吸收法。工业上可用NaClO碱性溶液吸收SO2。反应离子方程式是__________。为了提高吸收效率,常用Ni2O3作为催化剂。在反应过程中产生的四价镍和原子氧具有极强的氧化能力,可加快对SO2的吸收。该催化过程的示意图如下图所示:
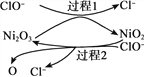
过程1:Ni2O3 +ClO- = 2NiO2 +Cl-,过程2的离子方程式是__________。
Ca(ClO)2也可用于脱硫,且脱硫效果比NaClO更好,原因是__________。
③电化学脱硫法。某种电化学脱硫法装置如下图所示,不仅可脱除SO2还可得到Cu。电解过程中发生总反应的离子方程式是__________。
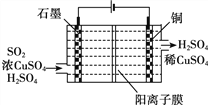
查看答案和解析>>
科目: 来源: 题型:
【题目】下列有关描述中正确的是( )
A.牺牲阳极的阴极保护法是应用电解原理防止金属的腐蚀
B.AlCl3溶液和Al2(SO4)3溶液分别加热蒸发,所得固体的成分相同
C.室温时将Na2CO3溶液加水稀释后,再恢复至室温,pH和KW均减小
D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol
查看答案和解析>>
科目: 来源: 题型:
【题目】下列电离方程式正确的是( )
A.H2CO32H++CO32﹣
B.NaHSO4=Na ++HSO4﹣
C.NaHCO3=Na++H++CO32﹣
D.NH4Cl=NH4++Cl﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com