
科目: 来源: 题型:
【题目】某原子的电子排布式为1s22s22p63s23p63d54s2,下列说法中不正确的是( )
A. 该元素原子中共有25个电子
B. 该元素原子核外有4个能层
C. 该元素原子最外层共有2个电子
D. 该元素原子M电子层共有8个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】将CO2转化为甲醇的原理为 CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H<0.500℃时,在体积为1L 的固定容积的密闭容器中充入1mol CO2、3mol H2 , 测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( ) 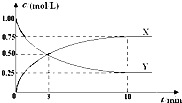
A.曲线X可以表示CH3OH(g) 或H2O(g) 的浓度变化
B.从反应开始到10min时,H2的反应速率v(H2)=0.225mol/(L﹒min)
C.平衡时H2 的转化率为75%
D.500℃时该反应的平衡常数K=3
查看答案和解析>>
科目: 来源: 题型:
【题目】铜锌原电池(如图)工作时,以下说法正确的是( ) ①电子流动方向从Zn﹣灯泡﹣Cu﹣盐桥;②Zn电极的质量减轻Cu电极的质量增重;③盐桥中的K+移向CuSO4溶液;④将锌片浸入硫酸铜溶液发生的化学反应与该电池反应相同为:Zn+Cu2+═Zn2++Cu;⑤Zn电极失电子发生还原反应.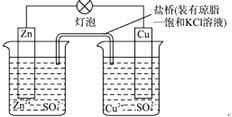
A.①②③
B.②④⑤
C.②③④
D.③④⑤
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:①4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H1=-akJ·mol-1
②4NH3(g)+3O2(g)=2N2(g)+6H2O(g)△H2=-bkJ·mol-1
③H2(g)+1/2O2(g)=H2O(g)△H3=-ckJ·mol-1
④H2(g)+1/2O2(g)=H2O(l)△H4=-dkJ·mol-1
下列叙述正确的是( )
A. 由上述热化学方程式可知△H3<△H4
B. H2的燃烧热为dkJ·mol-1
C. 4NH3(g)+4O2(g)=2NO(g)+N2(g)+6H2O(g)△H=(-a-b)kJ·mol-1
D. 4NH3(g)![]() 2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
2N2(g)+6H2(g)△H=(6d-b)kJ·mol-1
查看答案和解析>>
科目: 来源: 题型:
【题目】Ag2O2是银锌碱性电池的正极活性物质,可通过下列方法制备:在KOH加入适量AgNO3溶液,生成Ag2O沉淀,保持反应温度为80,边搅拌边将一定量K2S2O8溶液缓慢加到上述混合物中,反应完全后,过滤、洗涤、真空干燥得到固体样品.反应方程式为
2AgNO3+4KOH+K2S2O8![]() Ag2O2↓+2KNO3+2K2SO4+2H2O
Ag2O2↓+2KNO3+2K2SO4+2H2O
回答下列问题:
(1)上述制备过程中,检验洗剂是否完全的方法是
(2)银锌碱性电池的电解质溶液为KOH溶液,电池放电时正极的Ag2O2转化为Ag,负极的Zn转化为K2Zn(OH)4,写出该电池反应方程式: .
(3)准确称取上述制备的样品(设仅含Ag2O2和Ag2O) 2.558g,在一定的条件下完全分解为Ag 和O2,得到224.0mLO2(标准状况下).计算样品中Ag2O2的质量分数(计算结果精确到小数点后两位).
查看答案和解析>>
科目: 来源: 题型:
【题目】铁的单质及其作合物用途非常广泛。回答下列问题:
(1)某热电池放电时总反应为4Li+FeS2==Fe+2Li2S。该电池的正、负极材料分别是_______、____。
(2)Na2FeO4是一种优良的水处理剂。
①Na2FeO4可将水体中NH3转化为N2而除去同时产生红褐色沉淀,1mol Na2FeO4最多可脱除NH3的物质的量为______________________。
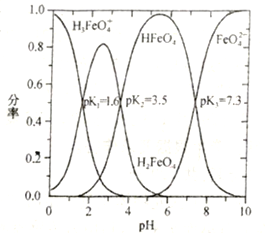
②Na2FeO4溶于水,溶液中含六价铁的微粒分率(某六价铁微粒数与所有六价铁微粒总数之比)与溶液pH关系如下图所示(已知常温下,H3FeO4+![]() H++H2FeO4,H2FeO4
H++H2FeO4,H2FeO4![]() H++HFeO4-,HFeO4-
H++HFeO4-,HFeO4-![]() H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O
H++FeO42-的电离常数依次为K1、K2、K3;pK=-lgK)。pH=3时,溶液中主要含铁微粒浓度从大到的小的顺序为________________;反应FeO42-+H2O![]() HFeO4-+OH-的pK=______。
HFeO4-+OH-的pK=______。
(3)CO还原铁的氧化物时,涉及以下反应:
a.Fe3O4(s)+4CO(g)![]() 3Fe(s)+4CO2(g)△H1
3Fe(s)+4CO2(g)△H1
b.FeO(g)+CO(g) ![]() Fe(s)+CO2(g)△H2
Fe(s)+CO2(g)△H2
c.3Fe2O3(s)+CO(g) ![]() 2 Fe3O4 (s)+CO2(g)△H3
2 Fe3O4 (s)+CO2(g)△H3
d. Fe3O4 (s)+CO(g) ![]() 3FeO(s)+CO2(g)△H4
3FeO(s)+CO2(g)△H4
相关反应的温度与混合气体中CO的体积分数的关系如下图所示:
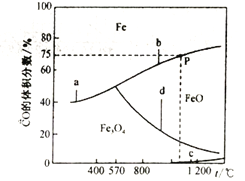
①反应的△H>0的是__________(选填a、b、c、d);△H4 =_______(用△H1、△H2表示)。
②在恒容密闭容器中,加入7.2gFeO,同时充入0.1molCO,升高温度,若恰好处于图中P点处,CO的转化率为_______,容器中生成单质Fe的质量为___________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】二氧化氯(ClO2)为一种黄绿色气体,是国际上公认的高效、广谱、快速、安全的杀菌消毒剂.目前已开发出用电解法制取ClO2的新工艺. 
(1)①如图装置用石墨作电极,在一定条件下电解饱和食盐水制取ClO2 . 写出阳极产生ClO2的电极反应式: . ②电解一段时间,当阴极产生的气体体积为112mL(标准状况)时,停止电解.通过阳离子交换膜的阳离子的物质的量为mol.
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了Y2O3的ZrO2晶体,在高温下它能传导O2﹣离子.电池工作时正极反应为 .
(3)若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液.
离子 | Cu2+ | H+ | Cl﹣ | SO42﹣ |
c/molL﹣1 | 1 | 4 | 4 | 1 |
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为mol.
查看答案和解析>>
科目: 来源: 题型:
【题目】X2+的核外电子排布式为1s22s22p6,下列说法正确的是( )
A. X可能为稀有元素 B. X原子的核外电子排布为1s22s22p63s2
C. X原子的核外电子排布为1s22s22p62d2 D. X2+的最外电子层上有6个电子
查看答案和解析>>
科目: 来源: 题型:
【题目】一种由富锰渣(含2MnO·SiO2、3MnO·Al2O3·3SiO2、FeO及重金属盐等)制备高纯MnCl2的工艺流程如下:

回答下列问题:
(1)“浸取”时的温度与四种元素的浸取率如图所示。

①工艺上控制75℃的主要原因是____________________________________________。
②铁和铝的浸出率从72℃明显下降的可能原因是___________________________________。
(2)“氧化”时发生反应的离子方程式为___________________________________________。
(3)通过调整pH可以“除铁和铝”。常温下,三种氢氧化物开始沉淀和沉淀完全(使其浓度小于1×10-6mol/L)的部分数据如下表:
Mn(OH)2 | Fe (OH)3 | Al(OH)3 | |
开始沉淀pH | 7.1 | 2.2 | 4. 1 |
沉淀完全pH | 10.8 | 3.5 | ? |
Al(OH)3沉淀完全的pH为______________{已知Ksp[Al(OH)3]=1×10-33};“调pH”时,应将溶液pH调整的范围是______________________。
(4)“除重金属”时,发生反应Hg2++MnS![]() HgS+M2+,其平衡常数K=___________[已知溶度积常数Ksp(HgS)=1.6×10-52,Ksp(MnS)=2.5×10-10,答案保留三位有效数学]。
HgS+M2+,其平衡常数K=___________[已知溶度积常数Ksp(HgS)=1.6×10-52,Ksp(MnS)=2.5×10-10,答案保留三位有效数学]。
(5)“步骤X”包含的操作有蒸发浓缩、__________、洗涤、干燥等。
查看答案和解析>>
科目: 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO2·SiO2,还含有少量Fe2O3、Al2O3、SiO2等杂质)通过如下方法制取。

已知:①ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
②部分金属离子在实验条件下开始沉淀和完全沉淀的pH如下表所示。
金属离子 | Fe3+ | Al3+ | ZrO2+ |
开始沉淀时pH | 1.9 | 3.3 | 6.2 |
沉淀完全时pH | 3.2 | 5.2 | 8.0 |
(1)“熔融”时ZrSiO4发生反应的化学方程式为________________________________。
(2)“滤渣Ⅰ”的化学式为________________。
(3)为使滤液Ⅰ中的杂质离子沉淀完全,需用氨水调pH=a,则a的范围是________;继续加氨水至pH=b时,所发生反应的离子方程式为__________________________________________。
(4)向“过滤Ⅲ”所得滤液中加入CaCO3粉末并加热,得到两种气体。该反应的离子方程式为____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com