
科目: 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列叙述错误的是( )
A.1.8g18O2分子与1.8g18O3分子中含有的中子数不同
B.7.8gNa2S和7.8g Na2O2中含有的阴离子数目均为0.1NA
C.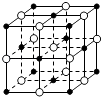 23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
23.4 g NaCl晶体中含有0.1NA个如图所示的结构单元
D.含16 g氧原子的二氧化硅晶体中含有的δ键数目为2NA
查看答案和解析>>
科目: 来源: 题型:
【题目】用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
A.H2O与BeCl2为角形(V形)
B.CS2与SO2为直线形
C.BF3与PCl3为三角锥形
D.SO3与CO ![]() 为平面三角形
为平面三角形
查看答案和解析>>
科目: 来源: 题型:
【题目】《中国诗词大会》不仅弘扬了中华传统文化,还蕴含着许多化学知识。下列诗句的有关说法错误的是
A. 王安石诗句“雷蟠电掣云滔滔,夜半载雨输亭皋”。雷雨天实现了大气中氮的固定
B. 于谦诗句“凿开混沌得乌金,藏蓄阳和意最深”。“ 乌金”指的是石油
C. 赵孟頫诗句“纷纷灿烂如星陨,霍霍喧逐似火攻”。灿烂的烟花与某些金属元素的焰色反应有关
D. 刘禹锡诗句“千淘万漉虽辛苦,吹尽黄沙始到金”。金性质稳定,存在游离态,可用物理方法获得
查看答案和解析>>
科目: 来源: 题型:
【题目】硼镁泥主要成分是MgO(占40%),还含有Na2B4O7、CaO、Al2O3、Fe2O3、FeO、MnO、SiO2等杂质。以硼镁泥为原料制取MgSO4·7H2O的工艺流程如下:
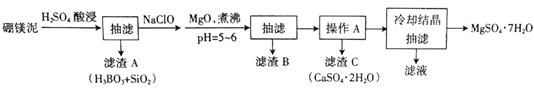
已知部分金属阳离子沉淀的pH:Fe(OH)3:3.2,Al(OH)3:5.2,Fe(OH)2:9.7,Mg(OH)2:11.2。
(1)为提高酸浸时浸出速率,可采取的措施有______________(写出两条)。
(2)H2SO4和Na2B4O7发生反应的化学方程式为________________。
(3)加入NaClO后可以生成一种不溶于水的黑色固体,则反应的离子方程式为_________。
(4)加MgO煮沸,并调整溶液pH=5~6的目的是_______________。
(5)已知MgSO4、CaSO4的溶解度如下表:
| 10℃ | 20℃ | 40℃ | 60℃ |
MgSO4 | 28.2 | 33.7 | 44.5 | 54.6 |
CaSO4 | 0.244 | 0.255 | 0.264 | 0.265 |
“操作A”是将MgSO4和CaSO4混合溶液中的CaSO4。除去,根据上表数据,步骤为________________,__________________。
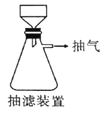
(6)本实验中多次用到抽滤操作,其装置如图,相比普通过滤,抽滤的优点是____________________。
(7)实验中提供的硼镁泥共100g,得到MgSO4·7H2O为172.2g,则MgSO4·7H2O的产率为__________。
查看答案和解析>>
科目: 来源: 题型:
【题目】我国天然气化工的一项革命性技术是甲烷在催化剂及无氧条件下,一步高效生产乙烯、芳烃等化工产品。以甲烷为原料合成部分化工产品流程如下(部分反应条件已略去):
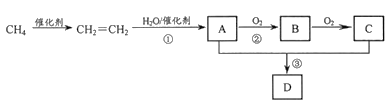
(1)A、C分子中所含官能团的名称分别为____、_______。
(2)写出A的同分异构体的结构简式:_______。
(3)写出下列反应的化学方程式和反应类型。
反应①:__________,反应类型:_____________;
反应②:___________;反应类型: _____________;
反应③:_____________,反应类型:_____________。
(4)下图为实验室制取D的装置图。
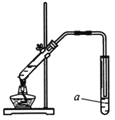
①图中试剂a名称为_______,其作用是______________。用化学方程式表示试剂a参与的化学反应:______________。
②实验结束后从混合物中分离出D的方法为_____________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应A+B―→C分两步进行:①A+B―→X,②X―→C,反应过程中能量变化如图所示,E1表示反应A+B―→X的活化能。下列有关叙述正确的是( )
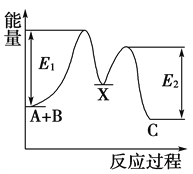
A. E2表示反应X―→C的活化能
B. X是反应A+B―→C的催化剂
C. 反应A+B―→C的ΔH<0
D. 加入催化剂可改变反应A+B―→C的焓变
查看答案和解析>>
科目: 来源: 题型:
【题目】肼(N2H4)是一种无色易溶于水的油状液体,具有碱性和极强的还原性,在工业生产中应用非常广泛。

(1)已知肼的球棍模型如图所示,写出肼的电子式:____________。
(2)已知1g肼(N2H4)气体燃烧生成氮气和水蒸气,放出16.7kJ的热量。写出该反应的热化学方程式:______________。
(3)目前正在研发的一-种肼燃料电池的结构如下图所示。
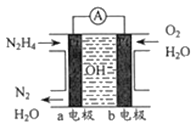
①该电池的负极是______(填“a”或“b”)电极。
②写出正极的电极反应式:_____________。
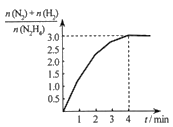
(4)在1L固定体积的容器中加入0.1molN2H4,在303K、Pt催化下发生反应:N2H4(l) ![]() N2(g)+2H2(g)。测得容器中
N2(g)+2H2(g)。测得容器中![]() 与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。
与时间关系如下图所示,则0~4min内氮气的平均反应速率v(N2)=______。
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,将H2(g)和I2(g)各1mol的气态混合物充入2L的密闭容器中,充分反应,5min后达到平衡,测得c(HI)=0.2mol/L.
(1)计算从反应开始至达到平衡,用H2(g)表示的反应速率.
(2)求该反应的平衡常数.
(3)保持温度不变,若向上述容器中充入H2(g)和I2(g)各2mol,求达到平衡时I2(g)的物质的量浓度.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com