
科目: 来源: 题型:
【题目】A是一种重要的基本化工原料,其产量可以用来衡量一个国家的石道化工发展水平。E是具有香味的液体。转化关系如下图所示(部分反应条件产物省略):
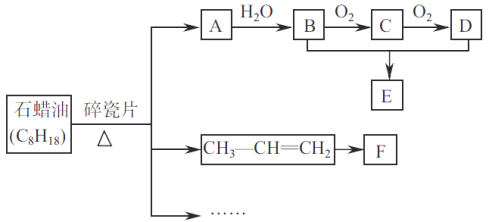
回答下列问题:
(1)A中所含官能团名称为_________________。由B和D生成E的化学方程式为________________。
(2)F为高分子化合物。可以用来制造汽车保险杠,其结构简式为__________________。
(3)设计实验证明A与溴水发生加成反应而不是取代反应__________________________。
(4)有机物X是石蜡油(C8H18)的同系物,分子中碳与氢的质量比为5:1,X的同分异构体共有____种,其中一氯代物只有一种的是__________(写结构简式)。
查看答案和解析>>
科目: 来源: 题型:
【题目】煤燃烧排放的烟气含有SO2和NOx , 形成酸雨、污染大气,采用NaClO2溶液作为吸收剂可同时对烟气进行脱硫、脱硝,回答下列问题:
(1)SO2分子的空间构型为 .
(2)在鼓泡反应器中通入含有SO2和NO的烟气,反应温度为323 K,NaClO2溶液浓度为5×10﹣3molL﹣1 . 反应一段时间后溶液中离子浓度的分析结果如表.
离子 | SO42﹣ | SO32﹣ | NO3﹣ | NO2﹣ | Cl﹣ |
c/(molL﹣1) | 8.35×10﹣4 | 6.87×10﹣6 | 1.5×10﹣4 | 1.2×10﹣5 | 3.4×10﹣3 |
①写出NaClO2溶液脱硫过程中主要反应的离子方程式 . 增加压强,SO2的转化率(填“提高”“不变”或“降低”).
②随着吸收反应的进行,吸收剂溶液的pH逐渐 (填“提高”“不变”或“降低”).
③由实验结果可知,脱硫反应速率脱硝反应速率(填“大于”或“小于”).原因是除了SO2和NO在烟气中的初始浓度不同,还可能是 .
(3)在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压Pa如图所示. 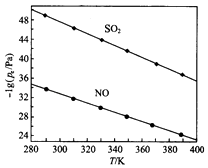
①由图分析可知,反应温度升高,脱硫、脱硝反应的平衡常数均(填“增大”“不变”或“减小”).
②反应ClO2﹣+2SO32﹣=2SO42﹣+Cl﹣的平衡常数K表达式为
(4)如果采用NaClO、Ca(ClO)2替代NaClO2 , 也能得到较好的烟气脱硫效果.从化学平衡原理分析,Ca(ClO)2相比NaClO具有的优点是 .
查看答案和解析>>
科目: 来源: 题型:
【题目】某学习小组拟探究CO2和锌粒反应是否生成CO,已知CO能与银氨溶液反应产生黑色固体。实验装置如图所示:
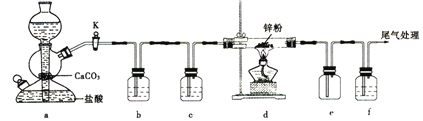
下列叙述正确的是
A. 装置e的作用是防倒吸
B. 如图所示装置的活塞K处于关闭状态
C. 实验结束时,先关闭活塞K,再熄灭酒精灯
D. b、c、f中的试剂依次为饱和碳酸钠溶液、浓硫酸、银氨溶液
查看答案和解析>>
科目: 来源: 题型:
【题目】以有机物A合成聚酯类高分子化合物F的路线如下图所示:

已知:RCH=CH3 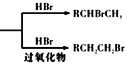
(1)A、C中含氧官能团的名称分别为_______,A生成B的反应类型为_________。
(2)D与NaOH水溶液反应的化学方程式为_________________________________。
(3)①E生成F的化学方程式为_____________________________________________。
②若F的平均相对分子质量为20000,则其平均聚合度为_____(填字母代号)。
A.54 B.108 C.119 D.133
(4)E在一定条件下还可以合成含有六元环结构的G,则G的结构简式为____________。
(5)满足下列条件的C的同分异构体有____种(不考虑立体异构)。
①含有1个六元碳环,且环上相邻4个碳原子上各连有一个取代基
②1mol该物质与新制氢氧化铜悬浊液反应产生2mol砖红色沉淀
(6)写出以![]() 为原料(其他试剂任选)制备化合物
为原料(其他试剂任选)制备化合物![]() 的合成路线,请用以下方式表示:
的合成路线,请用以下方式表示: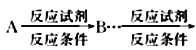 目标产物。__________________
目标产物。__________________
查看答案和解析>>
科目: 来源: 题型:
【题目】某草酸晶体的化学式可表示为H2C2O4xH2O,为测定x的值,进行下列实验: ①称取7.56g某草酸晶体配成100.0mL的水溶液,
②用移液管移取25.00mL所配溶液置于锥形瓶中,加入适量稀H2SO4 , 用浓度为0.600mol/L的KMnO4溶液滴定,滴定终点时消耗KMnO4 的体积为10.00mL.
(1)若滴定终点时仰视读数,则所测x的值将(填“偏大”或“偏小”).
(2)x= .
查看答案和解析>>
科目: 来源: 题型:
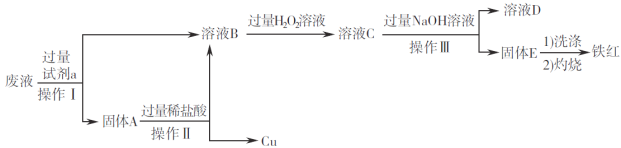
【题目】在FeCl3溶液蚀刻铜箔制造电路板的工艺中,废液(含有Fe2+、Fe3+、Cu2+)处理和资源回收很有意义。某兴趣小组设计了如下处理方案。
回答下列问题:
(1)固体A的成分是______________(填化学式)。
(2)由溶液B生成溶液C的离子方程式为___________________;检验溶液C中金属阳离子的试剂是____(填名称)。
(3)检验固体E是否洗涤干净的操作为____________________________;灼烧时,用于盛放固体E的仪器为____________________________(填名称)。
(4)铁红用途广泛,可用于焊接钢轨,写出该反应的化学方程式___________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】以铬铁矿[Fe(CrO2)2]为原料可制备K2Cr2O7和金属铬。实验流程如下:
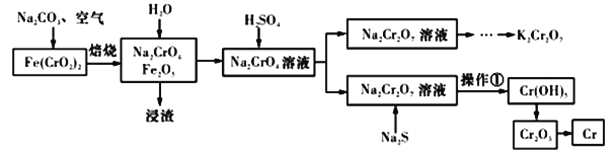
已知:2CrO42-+2H+=Cr2O72-+H2O。pH<3.0,CrO42-含量极小。
(1)写出铬铁矿焙烧转化为Na2CrO4的化学反应方程式:_____________________。焙烧时不能使用陶瓷容器的原因是________________________________________。
(2)判断加入稀硫酸的量已经足量的标准是_______________________________________。
(3)操作①包括过滤和洗涤。实验室洗涤沉淀的操作是________________________________。
(4)Na2S的作用是调节溶液的酸碱度和_____________________。
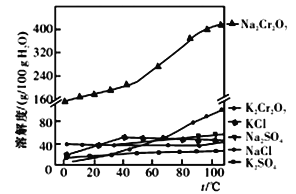
(5)Fe3+在pH为3.7时可完全转化为Fe(OH)3。在上述流程中所得Na2Cr2O7溶液中含有少量Fe3+。请结合上图有关物质的溶解度曲线,设计由Na2Cr2O7溶液制备K2Cr2O7固体的实验方案(实验中须选用的试剂:硫酸溶液、NaOH溶液、KCl固体、蒸馏水):
步骤①除杂质:__________________________________________________________________;
步骤②制备K2Cr2O7固体:__________________________________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】有资料显示过量的氨气和氯气在常温下可合成岩脑砂(主要成分为NH4Cl),某实验小组对该反应进行探究,并对岩脑砂进行元素测定。回答下列问题:
(1)岩脑砂的制备
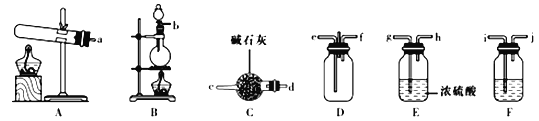
①该实验中用依盐酸与MnO2反应制取所需氯气,则装置F中的试剂是______(填试剂名称)。
②为了使氨气和氯气在D中充分混合,请确定上述装置的合理连接顺序:___→ef←____(用小写字母和箭头表示,箭头方向与气流方向一致)。________________
③装置D处有两个明显的不足之处,请指出________________________________。
④证明氨气和氯气反应有岩脑砂生成,需要的检验试剂中,除了蒸馏水、稀HNO3、NaOH溶液外,还需要_________________________________。
(2)岩脑砂中元素的测定准确称取ag岩脑砂,与足量的氧化铜混合加热(发生的反应为2NH4Cl+3CuO![]() 3Cu+N2↑+2HC1↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
3Cu+N2↑+2HC1↑+3H2O),利用下列装置测定岩脑砂中氮元素和氯元素的质量之比。
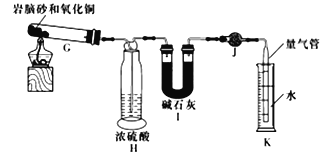
①设置装置H的目的是_____________________________________________。
②若装置I增重bg,利用装置K测得气体体积为VL(已知常温常压下气体摩尔体积为24.5L/mol),则岩脑砂中m(N):m(Cl)=________ (用含b、V的代数式表示,不必化简)。
若测量体积时气体温度高于常温(其他操作均正确),则m(N)比正常值____(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目: 来源: 题型:
【题目】A、B、C、D、E、F、G均是原子序数小于36的元素.A的基态原子外围电子排布式为3s2;B原子的L电子层的P能级上有一个空轨道; C元素的基态原子最外层有3个未成对电子,次外层有2个电子; D 的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;E是海水中除氢、氧元素外含量最多的元素;F和G在周期表中既处于同一周期又位于同一族,且原子序数F比G小2. 根据信息回答下列问题:
(1)C的外围电子排布图为 . C与氢元素可分别形成含10个电子的分子、阴离子和阳离子,阳离子中中心原子的杂化类型为
(2)用电子式表示化合物AE2的形成过程
(3)F与BD易形成配合物F(BD)5 , 在F(BD)5中F的化合价为
(4)E有多种含氧酸根①EO﹣②EO2﹣③EO3﹣④EO4﹣ , 其中空间构型为四面体形的是(填序号).
(5)C 的最高价氧化物对应的水化物与A 的单质反应时,C被还原到最低价,该反应的化学方程式为 .
查看答案和解析>>
科目: 来源: 题型:
【题目】水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.
(1)写出与H2O分子互为等电子体的一种阴离子的化学式为 .
(2)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+).下列对上述过程的描述不合理的是
A.氧原子的杂化类型发生了改变
B.微粒的形状发生了改变
C.微粒的化学性质发生了改变
D.微粒中的键角发生了改变
(3)向CuSO4溶液中滴加氨水,先产生蓝色沉淀,然后沉淀溶解,溶液呈深蓝色.请写出生成配合离子的离子方程式: .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com