
科目: 来源: 题型:
【题目】可充电电池在现代生活中有广泛应用.已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd+2NiOOH+2H2O ![]() Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
Cd(OH)2+2Ni(OH)2有关该电池的说法正确的是( )
A.放电时负极附近溶液的碱性不变
B.充电过程是化学能转化为电能的过程
C.充电时阳极反应:Ni(OH)2﹣e﹣+OH﹣═NiOOH+H2O
D.放电时电解质溶液中的OH﹣向正极移动
查看答案和解析>>
科目: 来源: 题型:
【题目】钾长石(K2Al2Si6O16)通常也称正长石,主要用于生产玻璃、陶瓷制品,还可用于制取钾肥。某学习小组以钾长石为主要原料,从中提取氧化铝、碳酸钾等物质,工艺流程如下:
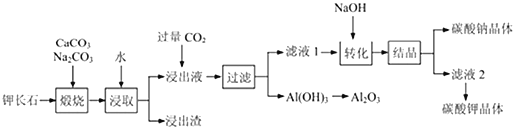
回答以下问题:
(1)请以氧化物组成的形式表示钾长石的化学式为_____________
(2)煅烧过程后,钾长石中的硅元素以______________(填化学式)的形式存在于浸出渣中;已知钾元素和铝元素在Na2CO3作用下转化为可溶性的KAlO2和NaAlO2,写出Al2O3与Na2CO3反应生成NaAlO2 的化学方程式______________________________。
(3)“浸取”过程中,需要将钾长石由块状固体粉碎为较小颗粒,其目的是___________
(4)“转化”时加入NaOH溶液的作用是_________________________ (用离子方程式表示)
(5)此工艺中可以循环利用的主要物质是___________、___________和水。
查看答案和解析>>
科目: 来源: 题型:
【题目】Ⅰ、已知34Se的原子结构示意图如图所示,回答下列问题:

(1)Se在元素周期表中的位置是__________。
(2)由Se在周期表中的位置分析判断下列说法正确的是__________。
A.热稳定性:PH3>H2S>H2Se B.还原性:H2Se>HBr>HCl
C.离子半径:Se2->Cl->K+ D.酸性:HClO3>HBrO3>H2SeO3
Ⅱ、已知:X表示卤族元素
(1)HClO的电子式是__________。
(2)氯气通入Ca(OH)2可以制得漂白粉,反应的化学方程式为__________。
(3)共价键的极性随着两元素的非金属性差异增大而增强,HX共价键的极性由强到弱的顺序是__________。
(4)不同卤素原子之间可形成卤素互化物,其性质与卤素单质相近。写出BrCl和SO2在水溶液中发生反应的化学方程式__________.
查看答案和解析>>
科目: 来源: 题型:
【题目】利用下图装置可以进行实验并能达到实验目的的是
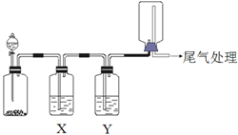
选项 | 实验目的 | X中试剂 | Y中试剂 |
A | 用MnO2和浓盐酸制取并收集纯净干燥的Cl2 | 饱和食盐水 | 浓硫酸 |
B | 用Cu与稀硝酸制取并收集纯净干燥的NO | 水 | 浓硫酸 |
C | 用Na2SO3和浓硫酸制取收集SO2并检验其性质 | 品红溶液 | 浓硫酸 |
D | 用CaCO3和稀盐酸制取并收集纯净干燥的CO2 | 饱和Na2CO3溶液 | 浓硫酸 |
A. A B. B C. C D. D
查看答案和解析>>
科目: 来源: 题型:
【题目】现有一瓶A和B的混合液,已知A和B的某些性质如下:
物质 | 分子式 | 熔点℃ | 沸点℃ | 密度gcm-3 | 水溶性 |
A | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
B | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
由此,分离A和B的最佳方法是 ( )
A. 萃取 B. 蒸馏 C. 升华 D. 分液
查看答案和解析>>
科目: 来源: 题型:
【题目】在2 L的密闭容器中发生反应xA(g)+yB(g) ![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )。
A.200 ℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B.200℃时,该反应的平衡常数为25 L2/mol2
C.当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D.由图乙可知,反应xA(g)+yB(g) ![]() zC(g)的ΔH<0,且a=2
zC(g)的ΔH<0,且a=2
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于氧化还原反应的叙述正确的是
A.含最高价元素的化合物一定有强氧化性
B.有一种元素被氧化,肯定有另一种元素被还原
C.还原剂得电子数与氧化剂失电子数一定相等
D.化学反应中不一定所有元素的化合价都发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】一定温度下,在固定体积的密闭容器中发生反应:2HI(g)![]() H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
H2(g)+I2(g)△H>0,0~15s内c(HI)由0.lmol/L降到0.07mol/L,则下列说法正确的是
A. 当HI、H2、I2浓度之比为2:1:1时,说明该反应达平衡
B. c(HI)由0.07mol/L降到0.05mol/L所需的反应时间小于10s
C. 升高温度正反应速率加快,逆反应速率减慢
D. 0~15s内用I2表示的平均反应速率为:v(I2)=0.001mol/(L·s)
查看答案和解析>>
科目: 来源: 题型:
【题目】工业上用含锰废料(主要成分MnO2,含有少量Fe2O3、Al2O3、CuO、CaO等)与烟气脱硫进行联合处理并制备MnSO4的流程如下:
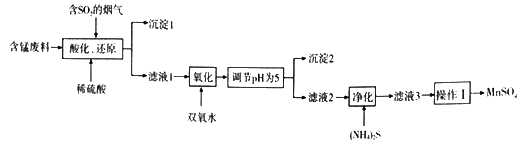
已知:25℃时,部分氢氧化物的溶度积常数(Ksp)如下表所示。
氢氧化物 | Al(OH)3 | Fe(OH)3 | Cu(OH)2 | Mn(OH)2 |
Ksp | 1.3×10-33 | 4.0×10-38 | 2.2×10-20 | 1.9×10-14 |
请回答:
(1)沉淀1的化学式为__________________。
(2)室温下,调节pH为5.试通过计算说明此时Al3+、Fe3+已沉淀完全,理由是_________。(NH4)2S的电子式为________________;“净化”时,加入(NH4)2S的作用为___________________。
(3)“酸化、还原”中,发生的所有氧化还原反应的离子方程式为__________________。
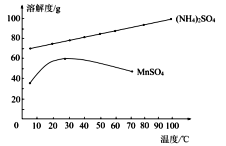
(4)已知:滤液3中除MnSO4外,还含有少量(NH4)2SO4。(NH4)2SO4、MnSO4的溶解度曲线如下图所示。
据此判断,操作“I”应为蒸发浓缩、____________、洗涤、干燥。
(5)工业上可用电解酸性MnSO4溶液的方法制备MnO2,其阳极反应式为________________。
(6)25.35 g MnSO4·H2O样品受热分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示。
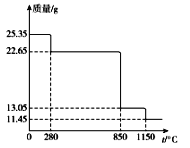
①300℃时,所得固体的化学式为______________________。
②1150℃时,反应的化学方程式为___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com