
科目: 来源: 题型:
【题目】Ⅰ.下表1是室温下,几种弱酸的电离平衡常数(Ka) 和弱碱的电离平衡常数(Kb)
表1
酸或碱 | 电离常数(ka或kb) |
CH3COOH | 1.75×l0-5 |
柠檬酸 (H3C6H5O7) | Kal=7.4×l0-4 Ka2=1.73×10-5 Ka3=4.0×l0-7 |
NH3·H2O | Kb=1.75×l0-5 |
请回答下面问题:
(1)用蒸馏水稀释0.1mol/L的醋酸溶液,下列选项中一定变小的是____________
A. ![]() B.c(H+) C.c(OH-)·c(H+) D.
B.c(H+) C.c(OH-)·c(H+) D. ![]()
(2)CH3COONH4的水溶液 呈_________(选填“酸性”、“ 中性”、“ 碱性”)。
(3)浓度为0.10mol/L柠檬酸氢二钠(Na2HC6H5O7) 溶液显________(填“酸”、“ 中”、“ 碱”)性,通过计算说明其原因____________。
Ⅱ.(1)乙醇是重要的化工产品和液体燃料,可以利用下列反应制取乙醇。2CO2(g)-6H2(g)![]() CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
CH3CH2OH(g)+3H2Og) △H=akJ/mol,在一定压强下,测得上述反应的实验数据如下表。
温度(K) CO2转化率 n(H2)/n(CO2) | 500 | 600 | 700 | 800 |
1.5 | 45% | 33% | 20% | 12% |
2.0 | 60% | 43% | 28% /td> | 15% |
3.0 | 83% | 62% | 37% | 22% |
根据表中数据分析:
①上述反应的α__________0(填“大于” 或“小于”)。
②在一定温度下,提高氢碳(即![]() )比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
)比。平衡常数 K值________(填“增大”、“ 减小”、或“不变”)。
(2) 催化剂存在的条件下,在固定容积的密闭容器中投入一定量的CO和H2,同样可制得乙醇(可逆反应)。该反应过程中能量变化如图所示:

在一定温度下,向上述密闭容器中加入1molCO、3molH2及固体催化剂,使之反应。平衡时,反应产生的热量为QkJ,若温度不变的条件下,向上述密闭容器中加入4molCO、12molH2及固体催化剂,平衡时,反应产生的热量为wkJ,则w的范围为___________。
(3)以乙醇蒸气、空气、氢氧化钠溶液为原料,石墨为电极可构成燃料电池,其工作原理与甲烷燃料电池原理相类似。该电池中负极上的电极反应式是__________________。使用上述乙醇燃料电池电解(Pt 电极)一定浓度的Na2CO3溶液,原理如图所示。阳极的电极反应式为____________________,阴极产生的物质A 的化学式为____________________。

查看答案和解析>>
科目: 来源: 题型:
【题目】铝是地壳中含量最多的金属元素,其单质和化合物广泛应用于日常生活中。
(1)铝粉和铁的氧化物(FeO-Fe2O3)可配成铝热剂用于焊接钢轨,反应的化学方程式是____。
(2)以铝土矿(主要成分为Al2O3.含SiO2和Fe2O3等杂质)为原料生产铝和铵明矾晶体[NH4Al(SO4)2·12H2O]的一种工艺流程如下(已知:SiO2在“碱溶”时转化为铝硅酸钠(NaAlSiO4·nH2O)沉淀)。

①实验前,要将铝土矿粉粹的目的是_______。
②用氧化物的形式表示铝硅酸钠的化学式________。
③步骤②涉及到的离子方程式是: _______。
④写出利用Al2O3制备金属Al的化学方程式: _______。
⑤若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1:1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为_______。
查看答案和解析>>
科目: 来源: 题型:
【题目】下列关于原电池的说法错误的是( )
A.原电池是将化学能转化为电能的装置
B.原电池负极发生氧化反应
C.原电池中,阳离子向负极移动
D.原电池电子流出的一极为负极
查看答案和解析>>
科目: 来源: 题型:
【题目】锂是密度最小的活泼金属,其单质及其化合物如:LiAlH4、Li2CO3、 LiPF6等有广泛的用途。工业上以锂辉石(主要成分为LiAlSi2O6,还含有硫酸钙、硫酸镁和铁的氧化物)为原料,制备Li2CO3的的工艺流程如下:

已知①LiAlSi2O6和H2SO4会生成SiO2
②
Fe3+ | A13+ | Fe2+ | Mg2+ | |
氢氧化物完全沉淀pH | 3.2 | 4.7 | 9.0 | 11.1 |
③某些物质的溶解度(S) 如下表
t/℃ | 20 | 40 | 60 | 80 |
S(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
S(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.7 |
请回答下列问题:
(1)LiAlSi2O6改写成氧化物的形式是___________________。
己知表中40℃Li2CO3溶解度(饱和溶液的密度为ag/cm3),则Li2CO3的溶度积(Ksp) 为________,(用含有a的代数式表示)
(2)步骤Ⅱ在滤液a中加入的除杂剂依次为适量的H2O2溶液,石灰乳和Na2CO3溶液,发生氧化还原反应的离子 方程式为____________________。
(3)己知滤渣2 的主要成分有Mg(OH)2 。向滤液a中加入石灰乳的作用是(运用化学平衡原理简述)___________________。用热水洗涤Li2CO3固体目的是___________________。
Ⅱ.锂单质制备及其化合物的性质
1)用碳酸锂和盐酸反应得到氯化锂溶液,写出如何从氯化锂溶液得到无水氯化锂固体的实验方法__________________。
(2) 已知2Li+H2![]() 2LiH,LiH固体密度为0 8g/cm3,用锂吸收22.4L (标准状况) H2, 生成的LiH体积与 被吸收 的 H2 体积 比 为________________。
2LiH,LiH固体密度为0 8g/cm3,用锂吸收22.4L (标准状况) H2, 生成的LiH体积与 被吸收 的 H2 体积 比 为________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】室温下,用相同物质的量浓度的HCl溶液,分别滴定物质的量浓度均为0.1mol·L-1的三种碱溶液。滴定曲线如图所示,下列判断正确的是
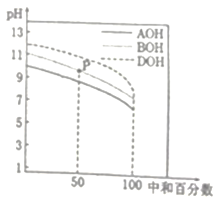
A. 滴定前,三种碱液中水电离的c(H+)大小关系:DOH>BOH>AOH
B. 满定至P 点时,溶液中:c(Cl-)>c(B+)>c(BOH)>c(OH-)>c(H+)
C. pH=7时,c(A+)=c(B+)=c(D+)
D. 当中和百分数达100%时,将三种溶液混合后:c(AOH)+c(BOH)+c(DOH) =c(H+)-c(OH-)
查看答案和解析>>
科目: 来源: 题型:
【题目】溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-中的几种。①若加入锌粒,产生无色无味的气体;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物貭的量之向的关系如图所示。则下列説法正确的是( )

A. 溶液中的阳离子一定含有H+、Mg2+、Al3+,可能含有Fe3+
B. 溶液中一定不含CO32-和NO3-,一定含有SO42-
C. 溶液中C(NH4+)=0.2mol/L
D. c(H+):c(Al3+):c(Mg2+)=l:1:1
查看答案和解析>>
科目: 来源: 题型:
【题目】下图是一种新型锂电池装置,电池充、放电反应为xLi+LiV3O8![]() Li1+xV3O8。 放电时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是
Li1+xV3O8。 放电时,需先引发铁和氯酸钾反应使共晶体熔化,下列说法不正确的是

A. 共晶盐储热效果好,利于电解质熔化
B. 整个过程的能量转化只涉及化学能转化为电能
C. 放电时LiV3O8电极反应为xLi++xe-+LiV3O8=Li1+xV3O8
D. 充电时Cl-移向LiV3O8电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com