
科目: 来源: 题型:
【题目】在密闭容器中进行可逆反应,A跟B反应生成C,反应速率v(A)、v (B)、v (C)之间存在以下关系:v (B)=3 v (A),v (C)=2 v (A),3 v (C)=2 v (B),则该反应可以表示为( )
A.A+3B ![]() 2C
2C
B.2A+2B ![]() 3C
3C
C.A+B ![]() C
C
D.3A+B ![]() 2C
2C
查看答案和解析>>
科目: 来源: 题型:
【题目】反应2A(g) + B(g) ![]() C(g) + 3D(g),达到平衡时,下列说法正确的是( )
C(g) + 3D(g),达到平衡时,下列说法正确的是( )
A. A、B全部变成了C和D
B. A、B、C、D四种物质的浓度一定相等
C. 反应速率为零
D. 单位时间内B消耗的物质的量和B生成的物质的量相等
查看答案和解析>>
科目: 来源: 题型:
【题目】[化学—选修5:有机化学基础]有机物F是一种香料,其合成路线如图所示:
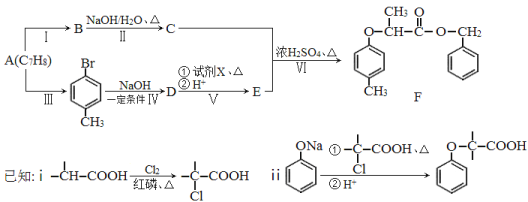
(1)A的名称为 ,试剂X的结构简式为 ,步骤Ⅵ的反应类型为 。
(2)步骤Ⅰ的反应试剂和条件分别为 、 。
(3)步骤Ⅱ反应的化学方程式为 。
(4)满足括号中条件(①苯环上只有两个取代基,②能与FeCl3溶液发生显色反应,③能发生水解反应和银镜反应)的E的同分异构体有 种,其中核磁共振氢谱峰面积比为6︰2︰2︰1︰1的分子的结构简式为 。
(5)依据题中信息,完成以![]() 为原料制取
为原料制取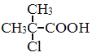 的合成路线图。
的合成路线图。
合成路线图示例如下:![]()
查看答案和解析>>
科目: 来源: 题型:
【题目】一个化学电池的总反应方程式为:Zn+Cu2+═Zn2++Cu,该化学电池的组成可能为( )
A | B | C | D | |
正极 | Cu | Cu | Zn | Al |
负极 | Zn | Zn | Cu | Zn |
电解质溶液 | H2SO4 | CuSO4 | ZnCl2 | Cu Cl2 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目: 来源: 题型:
【题目】1999年1月,俄美科学家联合小组宣布合成出114号元素的一种同位素,该同位素原子的质量数为298。以下叙述不正确的是( )
A. 该元素属于第七周期 B. 该元素位于ⅢA族
C. 该元素为金属元素,性质与82Pb相似 D. 该同位素原子含有114个电子,184个中子
查看答案和解析>>
科目: 来源: 题型:
【题目】英国曼彻斯特大学科学家安德烈·海姆和康斯坦丁。诺沃肖洛夫。共同工作多年的二人因“突破性地”用撕裂的方法成功获得超薄材料石墨烯而获诺贝尔奖。制备石墨烯方法有石墨剥离法、化学气相沉积法等。石墨烯的球棍模型示意图如下:

(1)下列有关石墨烯说法正确的是_________。
A.键长:石量烯>金刚石
B.石墨烯分子中所有原子可以处于同一平面
C.12g石墨烯含σ键数为NA
D.从石墨剥离得石墨烯需克服石墨层与层之间的分子间作用力
(2)化学气相沉积法是获得大量石墨烯的有效方法之一,催化剂为金、铜、钴等金属或合金,含碳源可以是甲烷、乙炔、苯、乙醇或酞菁等中的一种或任意组合。
①铜原子在基态时,在有电子填充的能级中,能量最高的能级符号为___________;第四周期元素中,最外层电子数与铜相同的元素还有_______________。
②乙醇的沸点要高于相对分子质量比它还高的丁烷,请解释原因_____________。
③下列分子属于非极性分子的是__________。
a.甲烷 b.二氯甲烷 c.苯 d.乙醇
④酞菁与酞菁铜染料分子结构如图,酞菁分子中氮原子采用的杂化方式是__________;酞菁铜分子中心原子的配位数为____________。
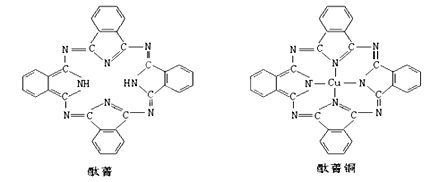
⑤金与铜可形成的金属互化物合金(如图,该晶胞中,Au占据立方体的8个顶点),它的化学式可表示为____________;在Au周围最近并距离相等的Cu有___________个,若2个Cu原子核的最小距离为dpm,该晶体的密度可以表示为_________g/cm3。(阿伏伽德罗常数用NA表示)

查看答案和解析>>
科目: 来源: 题型:
【题目】生物界与非生物界具有统一性,是因为
A. 构成细胞的化合物在非生物界都存在B. 构成细胞的无机物在非生物界都存在
C. 构成细胞的化学元素在非生物界都存在D. 生物界与非生物界都具有新陈代谢的功能
查看答案和解析>>
科目: 来源: 题型:
【题目】反应N2 (g) + 3H2(g) ![]() 2NH3(g),2 min内N2浓度减少了0.6 mol﹒L-1,对此反应速率的描述正确的是( )
2NH3(g),2 min内N2浓度减少了0.6 mol﹒L-1,对此反应速率的描述正确的是( )
A. 2min内H2的反应速率是0.4 mol/(L﹒min)
B. 2 min内N2、H2、NH3的反应速率之比是1﹕2﹕3
C. 在2min内,N2的反应速率是0.3 mol/(L﹒min)
D. 在2min末NH3的反应速率是0.2 mol/(L﹒min)
查看答案和解析>>
科目: 来源: 题型:
【题目】二甲醚又称甲醚,简称DME,熔点-141.5℃,沸点-24.9℃,与石油液化气(LPG)相似,被誉为“21世纪的清洁燃料”。制备原理如下:
Ⅰ.由天然气催化制备二甲醚:
①2CH4(g)+O2(g)![]() CH3OCH3(g)+H2O(g) △H1
CH3OCH3(g)+H2O(g) △H1
Ⅱ.由合成气制备二甲醚:
②CO(g)+2H2(g)![]() CH3OH(g) △H2=-90.7kJ·mol-1
CH3OH(g) △H2=-90.7kJ·mol-1
③2CH3OH(g)![]() CH3OCH3(g)+H2O(g) △H3
CH3OCH3(g)+H2O(g) △H3
回答下列问题:
(1)若甲烷和二甲醚的燃烧热分别是890.3kJ·mol-1、1453.0 kJ·mol-1;1mol液态水变为气态水要吸收44.0kJ的热量。反应③中的相关的化学健键能数据如表:
化学键 | H-H | C-O | H-O(水) | H-O(醇) | C-H |
E/(kJ mol-1) | 436 | 343 | 465 | 453 | 413 |
则△H1=_________kJ·mol-1 △H3=_________ kJ·mol-1
(2)反应③的化学平衡常数表达式为______________。制备原理Ⅰ中,在恒温、恒容的密闭容器中合成,将气体按n(CH4):n(O2)=2:1混合,能正确反映反应①中CH4的体积分数随温度变化的曲线是_________________。下列能表明反应①达到化学平衡状态的是_______________。
a.混合气体的密度不变
b.反应容器中二甲醚的百分含量不变
c.反应物的反应速率与生成物的反应速率之比等于化学计量数之比
d.混合气体的压强不变

(3)有人模拟制备原理Ⅱ,在500K时的2L的密闭容器中充入2molCO和6molH2,8min达到平衡,平衡使CO的转化率为80%,c(CH3OCH3)=0.3mol·L-1,用H2表示反应②的速率是__________;可逆反应③的平衡常数K3=_________。若在500K时,测得容器中n(CH3OH)=n(CH3OCH3),此时反应③v(正)___v(逆),说明原因____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com