
科目: 来源: 题型:
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)已知上述反应中相关的化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=______kJ·mol-1。
(2)为了加快该反应的速率,可以进行的措施是(_____)。
A.恒温恒压下,按原比例充入CH4、CO2
B.恒温下,缩小容器体积
C.增大反应物与催化剂的接触面积
D.降低温度
(3)恒温下,向2L体积恒定的容器中充入一定量的CO2、CH4,使其在催化剂作用下进行反应,经tmin后,测得CO有amol,则v(CO2)=______。下列各项能说明该反应达到平衡的是(______)。
A.容器内气体密度保持一定 B.容器内CO2、CH4的浓度之比为1∶1
C.该反应的正反应速率保持一定 D.容器内气体压强保持一定
(4)用甲烷作燃料的碱性燃料电池中,电极材料为多孔惰性金属电极,则负极的电极反应式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】模拟石油深加工合成CH2=CHCOOCH2CH3(丙烯酸乙酯)等物质的过程如下:

请回答下列问题:
(1)A能催熟水果,则A的名称为___________。
(2)B的结构简式为___________。
(3)苯生成硝基苯的反应类型为___________。
(4)石蜡油分解生成丙烯的同时,还会生成一种烷烃,该烷烃有______种同分异构体。
(5)写出由丙烯酸生成丙烯酸乙酯的化学方程式________________________。
查看答案和解析>>
科目: 来源: 题型:
【题目】反应SO2+O2=2SO3在密闭容器中进行。下列关于该反应的说法正确的是
A. 增大压强能减慢反应速率
B. v(SO2):v(O2)=2:1证明该反应已达到化学平衡状态
C. 当反应物和生成物浓度不变时,反应已达平衡
D. 增大02的浓度可使SO2完全转化
查看答案和解析>>
科目: 来源: 题型:
【题目】科学家合成了一种新型药剂(G),它被杂草吸收后能在其体内传导,甚至到达根部,从而使杂草彻底死亡。其合成路线如下:
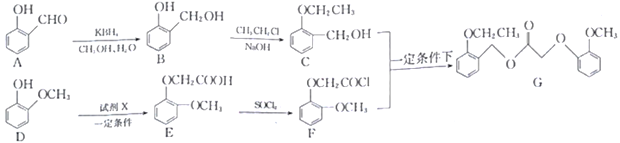
(1)中间体E中含氧官能团的名称_________________。
(2)A→B反应类型是_______________________。
(3)已知D→E转化的另一产物是HBr,则试剂X的结构简式为_________________。
(4)写出C+F→G的化学方程式:__________________________________。
(5)写出同时满足下列条件的E的同分异构体的结构简式________________ (写出一种即可)。
①属于芳香族化合物;
②磁共振氢谱有四组峰,峰面积比为1∶1∶2∶6;
③能发生银镜反应,水解产物之一能和FeCl3溶液发生显色反应。
(6)化合物H(H2NCH2CH2![]() OCH3)是合成利托君的重要中间体,写出以对-甲基苯酚和 CH3Br 为主要原料合成化合物H的路线:_____________________________________________(其他无机试剂任选)。
OCH3)是合成利托君的重要中间体,写出以对-甲基苯酚和 CH3Br 为主要原料合成化合物H的路线:_____________________________________________(其他无机试剂任选)。
提示:R—Cl![]() R—CN
R—CN![]() RCH2NH2
RCH2NH2
查看答案和解析>>
科目: 来源: 题型:
【题目】恒温下,物质的量之比为2∶1的SO2和O2的混合气体在容积为2L的恒容密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
2SO3(g)(正反应为放热反应),n(SO2)随时间变化关系如下表:
时间/min | 0 | 1 | 2 | 3 | 4 | 5 |
n(SO2)/mol | 0.20 | 0.16 | 0.13 | 0.11 | 0.08 | 0.08 |
下列说法正确的是( )
A. 该反应进行到第3分钟时,逆反应速率大于正反应速率
B. 若要提高SO2的转化率,可用空气代替纯氧气并鼓入过量空气
C. 从反应开始到达到平衡,用SO3表示的平均反应速率为0.01mol/(L·min)
D. 容器内达到平衡状态时的压强与起始时的压强之比为5∶4
查看答案和解析>>
科目: 来源: 题型:
【题目】已知Ksp(AgCl)=1.56×10-10,Ksp(AgBr)=7.7×10-13,Ksp(Ag2CrO4)=9.0×10-12.某溶液中含有Cl-、Br-和CrO42-浓度均为0.010mol.L-1,向该溶液中逐滴加入0.010mol.L-1的AgNO3溶液时,三种阴离子产生沉淀的先后顺序为( )
A. Cl-、Br-、CrO42- B. CrO42-、Br-、Cl-
C. Br-、Cl-、CrO42- D. Br-、CrO42-、Cl-
查看答案和解析>>
科目: 来源: 题型:
【题目】硫酸亚铁铵品体[(NH4)2Fe(SO4)2·6H2O]又称摩尔盐,是一种重要的化工原料,用途十分广泛。
(1)基态Fe2+的核外电子排布式为_____________________。
(2)氨是合成摩尔盐的重要原料,工业合成氨中,原料气在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收其中的杂质CO气体,其反应方程式为:[Cu(NH3)2]Ac+CO+NH3![]() [Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)](Ac-=CH3COO-)
[Cu(NH3)3]Ac·CO[醋酸羰基三氨合铜(I)](Ac-=CH3COO-)
①醋酸中碳原子的杂化方式是_________,1mol乙酸分子中含有σ键的数目为_________________。
②C、N、O三种元素的第一电离能由小到大的顺序为___________________________。
③与CO互为等电子体的分子为___________(填化学式),NH3的空间构型为__________________。
(3)N和P都是第VA族元素,其最简单氢化物熔点的大小关系为_________,主要原因是__________________________________。
(4)铁在不同温度范围有不同的晶体结构。室温下铁是简单立方,称为α铁(α-Fe)。当温度升高到912℃,α铁转变为面心立方,称为γ铁(γ-Fe)。当温度继续升高到1394 ℃,γ铁转变为体心立方。称为δ铁(δ-Fe)。

①γ铁晶体中铁原子配位数是____________________。
②δ铁晶体密度为dg·cm-3,则其晶胞参数(边长)为__________cm(阿伏加德罗常数用NA表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为:Pb+PbO2+4H++2SO42﹣![]() 2PbSO4+2H2O则下列说法正确的是( )
2PbSO4+2H2O则下列说法正确的是( )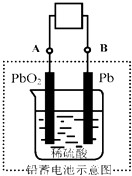
A.放电时:电子流动方向由A经导线流向B
B.放电时:正极反应是Pb﹣2e﹣+SO42﹣ ![]() PbSO4
PbSO4
C.充电时:铅蓄电池的负极应与充电器电源的正极相连
D.充电时:阳极反应是PbSO4﹣2e﹣+2H2O=PbO2+SO42﹣+4H+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com