
科目: 来源: 题型:
【题目】在一定温度下,将冰醋酸加水稀释的过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.
请回答下列问题:
(1)“O”点冰醋酸不能导电的原因是 .
(2)a、b、c三点对应的溶液中,C(H+)由小到大的顺序为 . (填字母,后同)
(3)a、b、c三点对应的溶液中,CH3COOH的电离程度最大的是 .
(4)a、b、c三点对应的溶液中,水的电离程度最大的是 .
(5)若使c点对应的溶液中的c(CH3COO﹣)增大,在下列措施中,可行的是(填字母,后同).
A.加热
B.加KOH固体
C.加水
D.加CH3COONa固体
E.加锌粒
(6)在稀释过程中,随着醋酸浓度的降低,下列各量始终保持增大趋势的是 .
A.C(H+)
B.H+物质的量
C.C(OH﹣)
D.![]() .
.
查看答案和解析>>
科目: 来源: 题型:
【题目】物质结构决定性质,新材料的不断涌现有力地促进了社会进步,因此了解物质结构具有重要意义。试回答下列问题:
(1)基态铁原子中未成对电子数为_________,在水溶液中常以Fe2+、Fe3+的形式存在,其中________更稳定。
(2)OF2中氧元素的化合价为____,中心原子的杂化方式为___,OF2的分子极性比H2O的__________(选填“大”或“小”)。
(3)一种新型铝离子电池中的电解质溶液由某种有机阳离子与AlCl4﹣、Al2Cl7﹣构成,AlCl4﹣的立体构型为_________,Al2Cl7﹣中的原子都是8电子结构,则Al2Cl7﹣的结构式为(配位键用“→”表示)__________。
(4)FeO晶体与NaCl晶体结构相似,要比较FeO与NaCl的晶格能大小,还需要知道的数据是___________;
(5)氮化铝、氮化硼、氮化镓晶体的结构与金刚石相似,它们晶体的熔点由高到低的顺序是___________。
(6)NH3分子中∠HNH键角为106.7,而配离子[Zn(NH3)6]2+中∠HNH键角为109.5, 配离子[Zn(NH3)6]2+中∠HNH键角变大的原因是_____。
(7)下图是Fe3O4晶体的晶胞。
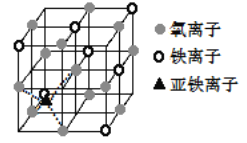
①晶胞中亚铁离子处于氧离子围成的______(选填“正方形”、“正四面体”或“正八面体”)空隙。
②晶胞中氧离子的堆积方式的名称为________。
③若晶胞的体对角线长为 a nm,则 Fe3O4 晶体的密度为________g/cm3(阿伏加德罗常数用 NA 表示)。
查看答案和解析>>
科目: 来源: 题型:
【题目】图1是铜锌原电池示意图,图2中轴表示实验时流入正极的电子的物质的量, y轴表示
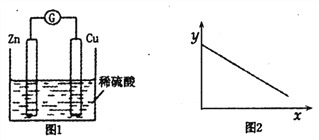
A. 铜棒的质量 B. c(H+) C. c(SO42-) D. c(Zn2+)
查看答案和解析>>
科目: 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述不正确的是
A. 原子半径的大小顺序为X<W<Y<Z B. WX2、YX2和ZX2均只含共价键
C. W、X、Y、Z最外层电子数之和为20 D. Z的气态氢化物比Y的稳定
查看答案和解析>>
科目: 来源: 题型:
【题目】下列说法正确的是
A. 需要加热才能发生的化学反应都是吸热反应
B. 应用盖斯定律可以计算某些难以测量的反应焓变
C. 任何能使熵值增大的过程都能自发进行
D. 化学平衡发生移动,平衡常数一定发生变化
查看答案和解析>>
科目: 来源: 题型:
【题目】某温度下,H2(g)+CO2(g)H2O(g)+CO(g)的平衡常数K= ![]() ,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
,该温度下在甲、乙、丙三个恒容密闭容器中,投入H2(g)和CO2(g),其起始浓度如表所示,下列判断不正确的是( )
起始浓度 | 甲 | 乙 | 丙 |
c(H2)/molL﹣1 | 0.010 | 0.020 | 0.020 |
c(CO2)/molL﹣1 | 0.010 | 0.010 | 0.020 |
A.平衡时,乙中CO2的转化率大于60%
B.平衡时,甲中和丙中H2的转化率均是60%
C.平衡时,丙中c(CO2)是甲中的2倍,是0.012 molL﹣1
D.反应开始时,丙中的反应速率最快,甲中的反应速率最慢
查看答案和解析>>
科目: 来源: 题型:
【题目】甲烷以天然气和可燃冰两种主要形式存在于地球上,储量巨大,充分利用甲烷对人类的未来发展具有重要意义。
(1)乙炔(CH≡CH)是重要的化工原料。工业上可用甲烷裂解法制取乙炔,反应为:2CH4(g)![]() C2H2(g)+ 3H2(g)。甲烷裂解时还发生副反应: 2CH4(g)
C2H2(g)+ 3H2(g)。甲烷裂解时还发生副反应: 2CH4(g)![]() C2H4(g)+2H2(g)。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgP与温度(℃)之间的关系如图所示。
C2H4(g)+2H2(g)。甲烷裂解时,几种气体平衡时分压(Pa)的对数即lgP与温度(℃)之间的关系如图所示。
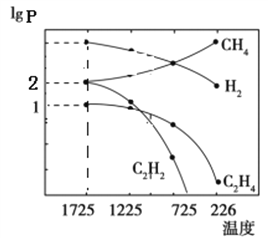
①1725℃时,向恒容密闭容器中充入CH4,达到平衡时CH4生成C2H2的平衡转化率为_______。
②1725℃时,若图中H2的lgP=5,则反应2CH4(g)![]() C2H2(g)+ 3H2(g)的平衡常数Kp=_________(注:用平衡分压Pa代替平衡浓度mol/L进行计算)。
C2H2(g)+ 3H2(g)的平衡常数Kp=_________(注:用平衡分压Pa代替平衡浓度mol/L进行计算)。
③根据图判断,2CH4(g)![]() C2H2(g)+3H2(g)△H_____0(填“>”或“<”)。由图可知,甲烷裂解制乙炔过程中有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有_______。
C2H2(g)+3H2(g)△H_____0(填“>”或“<”)。由图可知,甲烷裂解制乙炔过程中有副产物乙烯生成。为提高甲烷制乙炔的产率,除改变温度外,还可采取的措施有_______。
(2)工业上用甲烷和水蒸气在高温和催化剂存在的条件下制得合成气(CO、H2),发生反应为:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) △H>0
CO(g)+3H2(g) △H>0
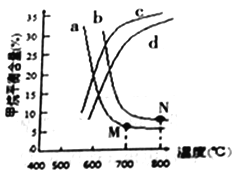
图中a、b、c、d四条曲线中的两条代表压强分别为1MPa、2MPa时甲烷含量曲线,其中表示1MPa的是________(填字母)。在实际生产中采用图中M点而不是N点对应的反应条件,运用化学反应速率和平衡知识,同时考虑实际生产,说明选择该反应条件的主要原因是__________。
(3)利用CH4、CO2在一定条件下重整的技术可得到富含CO的气体,在能源和环境上具有双重重大意义。重整过程中的催化转化原理如图所示:

已知: CH4(g)+ H2O(g) ![]() CO (g )+ 3H2(g) △H =+206.2 kJ/mol
CO (g )+ 3H2(g) △H =+206.2 kJ/mol
CH4(g)+ 2H2O(g) ![]() CO2(g )+4H2(g) △H =+158.6 kJ/mol
CO2(g )+4H2(g) △H =+158.6 kJ/mol
则:
①过程II中第二步反应的化学方程式为__________。
②只有过程I投料比![]() =______,过程II中催化剂组成才会保持不变。
=______,过程II中催化剂组成才会保持不变。
③该技术总反应的热化学方程式为_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】设NA代表阿伏加德罗常数的值,下列说法正确的是
A. 常温下28gN2含有的电子数为10NA
B. 标准状况下,22.4LH2O含有的分子数是NA
C. 室温下44gCO2含有的分子数是NA
D. 100mL1mol·L-1盐酸中含有的HCl分子数是0.1NA
查看答案和解析>>
科目: 来源: 题型:
【题目】某工厂将制革工业污泥中的铬元素以难溶物CrOH(H2O)5SO4的形式回收,工艺流程如下,其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
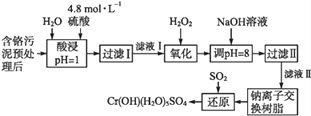
回答下列问题:
(1)4.8 mol/L的硫酸溶液密度为1.27g/cm3,该溶液中硫酸的质量分数是_______。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:______。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 | — | — | — |
沉淀完全时的pH | 3.7 | 11.1 | 5.4(>8溶解) | 9(>9溶解) |
①Cr (OH)3溶解于NaOH溶液时反应的离子方程式是___________。
②加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有______;但溶液的pH不能超过8,其理由是______________________________。
(4)钠离子交换树脂的反应原理为Mn++nNaR→MRn+nNa+,利用钠离子交换树脂除去滤液Ⅱ中的金属阳离子是_____________。
(5)写出上述流程中用SO2进行还原时发生反应的化学方程式:_______________。
查看答案和解析>>
科目: 来源: 题型:
【题目】已知:25℃,NH3·H2O电离平衡常数K=1.76×10-5。25℃,向1 L 0.1 mol/L某一元酸HR溶液中逐渐通入氨气,若溶液温度和体积保持不变,所得混合溶液的pH与![]() 变化的关系如图所示。下列叙述正确的是
变化的关系如图所示。下列叙述正确的是
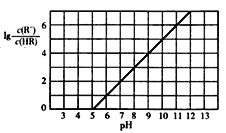
A. 由图可推知:25℃,0.1 mol/L NaR溶液的pH约为10
B. 当通入0.1 mol NH3时,所得溶液中:c(NH4+)>c(R-)>c(OH-)>c(H+)
C. pH=7时,所得溶液中:c(HR)>c(R-) =c(NH4+)
D. pH=10时,所得溶液中:c(R-)>c(HR) ,c(NH4+)>c(NH3·H2O)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com